전이성 유방암 환자에서 Cisplatin과 Etoposide 항암화학요법을 이용한 치료
Treatment with Cisplatin and Etoposide Chemotherapy in Patient with Metastatic Breast Cancer
Article information
Trans Abstract
Purpose
Both the incidence of breast cancer as well as, the number of patients with metastatic breast cancer has increased. Taxane and anthracycline chemotherapy is known to be effective in metastatic breast cancer; however, the subsequent treatment option when such treatment fails remains unestablished. The aim of the present study was to analyze the effect and response of cisplatin and etoposide treatment along with the predictive factor for patients who failed taxane and anthracycline chemotherapy for metastatic breast cancer.
Methods
Forty-three patients with breast cancer whose regimen was changed to cisplatin and etoposide chemotherapy from taxane and anthracycline chemotherapy owing to treatment failure were included in this study. The chemotherapy regimen consisted of intravenous injection of 100 mg/m2 etoposide and 70 mg/m2 cisplatin on day 1 and then intravenous injection of 100 mg/m2 etoposide on days 2 and 3. This cisplatin and etoposide chemotherapy was repeated at 3 week intervals, and patients were assessed after the 2nd or 3rd cycle of therapy to evaluate the tumor response.
Results
The average cycle and progression-free survival of cisplatin and etoposide chemotherapy were 4±3.1 (range, 1–16) and 12±14.2 weeks (range, 0–60 weeks), respectively. The average overall survival was 44±33.9 months (range, 11–149 months). The treatment response group consisted of 23 patients (53.5%) who continuously received cisplatin and etoposide chemotherapy for over four cycles, while the non-response group consisted of 20 patients (46.5%) who underwent three or fewer cycles of chemotherapy. Patients with excellent response to cisplatin and etoposide chemotherapy also showed good response to taxane and anthracycline chemotherapy (p=0.011).
Conclusion
In patients who show good response to taxane and anthracycline chemotherapy, cisplatin and etoposide chemotherapy is also expected to have a positive result.
서 론
유방암은 세계적으로 발생률이 증가하고 있고 한국에서는 여성암 중 갑상선암에 이어 2위를 차지할 정도로 발생 빈도가 높다[1,2]. 유방암으로 진단받은 환자 중 10% 미만이 국소 진행성 또는 전이성 질환을 가지고 있으며 진단 시 전이가 없는 환자의 30%에서 50%는 호르몬치료 및 항암화학요법 등의 보조 치료에도 불구하고 전이성 유방암으로 진행하게 된다[3]. 한국의 유방암 5년 생존율은 92%로 북미나 유럽 같은 주요 의료 선진국보다도 높은 수치를 보이나[2] 병기에 따른 유방암의 5년 생존율은 1기가 97.2%, 2기가 92.8%인데 비해 4기 환자들의 5년 생존율은 44.1%로 예후가 좋지 않으며 기대수명도 낮다[2,4].
전이성 유방암의 치료에 사용되는 항암제는 여러 가지가 있으나 taxane, anthracycline 항암화학요법이 전이성 유방암 환자의 치료에 효과적인 약제로 알려져 있고 전이성 유방암 환자의 1차 항암치료요법(first line chemotherapy) 중 하나로 사용된다[4-8]. 여러 예측 인자들이 사용되고 있지만 taxane, anthracycline 요법이 실패하여 다른 항암요법약물로 변경해야 할 경우 약물 결정에 대한 가이드라인이 없고 경험적인 사용 결과를 근거로 항암치료 약제를 결정해야 하는 어려움이 있다[7-9].
Cisplatin, etoposide는 전이성 유방암에서 사용할 수 있는 여러 항암화학요법 중 하나로 cisplatin은 유방암, 고환암, 난소암, 두경부암 등 여러 암의 치료에 사용되는 약제로 백금(platinum)을 기반으로 한 항종양 제제 계열의 약물이다[10]. Cisplatin은 DNA에 반응하고 DNA 사슬 사이나 사슬 내에 가교를 형성해 DNA 합성을 저해하여 DNA 복제를 방해하는 역할을 한다[11]. Etoposide는 고환암, 폐암, 난소암 등 여러 종류의 암 치료에 사용되는 약물로 DNA와 topoisomerase II 효소와 3차원 복합체를 형성하여 DNA 나선의 재결합을 방지하여 DNA 합성을 방해한다. 빠르게 분열하는 암세포의 경우 더 많은 DNA 합성 오류를 일으켜 암세포의 세포 사멸을 촉진시킨다[12]. Cisplatin과 etoposide는 전이성 유방암 치료에서 좋은 반응률을 보여주고 있으며 동물 실험 모델에서 함께 사용하였을 때 효과가 입증되었고, 여러 논문에서 cisplatin과 etoposide의 시너지 효과가 입증되었다[9,13-16].
본 연구에서는 taxane, anthracycline 요법에 실패한 전이성 유방암 환자 중 cisplatin, etoposide 항암화학요법을 사용한 환자를 대상으로 치료 효과와 치료 반응률을 살펴보고 환자들의 특징을 비교해 보았다.
방 법
대상 환자
대상 환자는 2010년 1월부터 2015년 12월까지 충남대학교병원에서 전이성 유방암으로 진단받은 후 1차 항암치료로 taxane, anthracycline 항암화학요법을 시행 받고 cisplatin, etoposide 항암화학요법으로 변경한 43명을 대상으로 하였다. 환자들의 의무기록과 병리조직 검사 결과를 토대로 유방수술 유무, 일상생활 수행능력(Eastern Cooperative Oncology Group, ECOG), TNM 병기, 호르몬 수용체의 상태, human epidermal growth factor receptor 2 (HER2) 발현 여부, 전이 장기 및 사망일, 마지막 외래 추적 관찰일 등을 후향적으로 분석하였다. 환자들은 혈액검사(백혈구 수, 호중구 수, 혈소판 수, aspartate transaminase/alanine transaminase [AST/ALT])와 이학적 검사를 통해 항암 시행 여부를 결정하였고 43명의 환자는 모두 taxane, anthracycline 항암화학요법을 시행받았다. Taxane, anthracycline을 포함하여 모든 항암요법들은 2–3주기마다 반응평가를 시행하였다. 반응평가에서 Response Evaluation Criteria In Solid Tumors (RECIST) criteria [17]상 진행성 질환(progressive disease)으로 분류된 환자들은 다른 항암요법으로 변경하여 치료를 진행하였다. 다른 악성 질환의 과거력이 있는 환자나 유방암 이외의 다른 이유로 사망한 환자, 의무기록이 분실되거나 미흡한 환자의 경우 연구에서 제외하였다.
Cisplatin, etoposide 용법
Cisplatin, etoposide 항암화학치료는 항암 시작 첫날 etoposide 100 mg/m2을 normal saline (NSS) 500 mL에 섞어 2시간 동안 정주한 후 cisplatin 70 mg/m2을 NSS 500 mL에 섞어 2시간 동안 정주하였다. 항암 시작 둘째, 셋째 날에는 etoposide 100 mg/m2을 NSS 500 mL에 섞어 2시간 동안 정주하였다. Cisplatin, etoposide 요법은 3주 간격으로 시행하였고 종양의 반응도를 평가하기 위해 모든 환자는 항암치료 2–3주기 후에 반응 정도를 평가하였다.
반응평가 후 환자들은 완전 반응(complete response), 부분 반응 (partial response), 안정성 질환(stable disease), 진행형 질환(progressive disease)으로 분류하였다. 완전 반응의 경우 모든 병변의 소멸, 부분 반응은 모든 병변의 최장 직경의 합에서 30% 이상의 감소, 안정성 질환은 모든 병변의 최장 직경의 합에서 30% 이하의 감소 혹은 20% 이하의 증가, 진행형 질환은 최초의 병변에서 20% 이상의 증가 혹은 새로운 병변으로 RECIST criteria 기준을 따랐다.
Cisplatin, etoposide 항암화학치료를 받은 환자들은 반응평가 후 치료 반응군(responder)과 비반응군(non-responder)으로 분류하였다. 치료 반응군은 반응평가에서 부분 반응, 안정성 질환으로 평가되어 cisplatin, etoposide 항암화학요법을 4차 이상 유지한 군으로 정의하였다. 비반응군은 반응평가에서 진행형 질환으로 분류되어 cisplatin, etoposide 요법을 중지하고 다른 항암화학요법으로 항암제를 바꾼 군으로 cisplatin, etoposide 항암화학요법은 3차 이하로 시행하였다.
데이터 분석
43명의 환자를 대상으로 cisplatin, etoposide 항암화학요법의 치료 반응군과 비반응군 간의 특징을 비교하였다. 전체 생존율(overall survival)은 유방암 진단 당시부터 마지막 추적 관찰까지의 기간 (환자 사망 포함)으로 설정하였고, 무진행 생존율(progression-free survival)은 항암화학요법을 시작한 날부터 진행형 질환으로 평가되거나 새로운 전이가 발견된 날까지로 정의하였다.
통계는 IBM SPSS software version 18.0 (SPSS Inc., Chicago, USA) 프로그램을 이용하여 분석하였다. 연속 변수는 범위를 가진 중간값으로 표현하였고, 단변량 분석은 Student t-test와 chi-square test를 사용하였고 Kaplan-Meier analysis로 생존율을 산출하고 log-rank test로 비교하였다. 양측 검정을 이용하여 유의수준 0.05 미만(p < 0.05)인 경우 의미 있는 차이가 있다고 보았다.
결 과
환자 특성
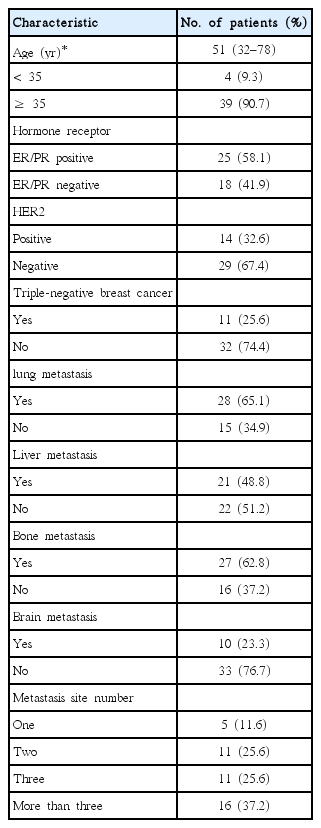
대상 환자의 성별은 여자가 42명, 남자가 1명이었고, 평균 연령은 51세(범위, 32–78세)로 35세 미만이 4명(9.3%), 35세 이상은 39명 (90.7%)이었다. 유방암 진단 후 43명의 환자 중 7명(16.3%)이 유방보존수술, 31명(72.1%)이 유방전절제술을 시행하였다. 5명(11.6%)은 원격전이로 수술을 진행하지 않았다(Table 1).
Cisplatin, etoposide 항암화학요법 시행 당시 환자들의 ECOG는 0–2이었다. 혈색소는 9.5 g/dL 이상(9.5–14.0), 호중구는 1,400/mm3 이상(1,400–7,500), 혈소판은 127,000/uL 이상(127,000–452,000)이었고, AST/ALT는 정상 상한치의 2배 미만이었다. Estrogen receptor/progesterone receptor (ER/PR) 양성인 환자는 25명(58.1%)이었고, HER2 유전자 과발현인 환자는 14명(32.6%), 삼중음성유방암인 환자는 11명(25.6%)이었다. 환자들은 cisplatin, etoposide 항암화학요법을 시행할 당시 4기였으며, 폐전이가 28명(65.1%)으로 가장 많았고 뼈전이가 27명(62.8%), 간전이는 21명(48.8%)이었다(Table 2).
Cisplatin, etoposide 요법의 특징
전이성 유방암 환자 중에서 cisplatin, etoposide 항암화학요법을 사용한 환자 43명을 후향적으로 분석해 보았다. Cisplatin, etoposide 항암화학요법으로 치료받은 환자들의 평균 치료 횟수는 4 ± 3.1회 (범위, 1–16회)였으며 치료에 반응이 좋았던 환자의 경우 16차까지 항암요법을 시행하였다. 무진행 생존율은 평균 12–14.2주(범위, 0–60주)였다. 전체 생존기간은 평균 44± 33.9개월(범위, 11–149개월)이었다.
환자들은 cisplatin, etoposide 항암화학치료 2–3차 후에 반응평가를 진행하였고 4차 이상 항암을 유지한 치료 반응군과 3차 이하로 항암을 시행 후 다른 항암제로 변경한 비반응군으로 나누었다. 치료 반응군은 23명, 비반응군은 20명이었다. 43명 중 23명의 환자에서 부분 반응과 안정성 질환을 보여 반응률은 53.5%였다. 치료 반응군과 비반응군은 성별(p = 0.535), 나이(p = 0.072), 수술의 종류(p = 0.189)에서 통계학적으로 유의한 차이를 보이지 않았다(Table 3).
환자들의 무병기간(disease-free interval)을 24개월 미만, 24개월 이상으로 나누었을 때 두 군 간 차이는 없었다(p = 0.734). 호르몬 수용체는 치료 반응군에서 12명(27.9%), 비반응군에서 13명(30.2%)으로 통계적으로 유의하지 않았다(p = 0.295). HER2 양성 유무도 통계학적으로 유의한 차이를 보이지 않았다(p = 0.502). 삼중음성유방암 여부도 치료 반응군이 7명(16.2%), 비반응군이 4명(9.3%)으로 치료 반응군에서 높은 경향을 보였으나 두 군 간 통계학적으로 유의한 차이는 보이지 않았다(p = 0.335).
보조 방사선 치료를 시행받은 환자는 18명으로 치료 반응군이 8명(18.6%), 비반응군은 10명(23.2%)이었고 호르몬 치료는 17명의 환자가 시행 받았으며 치료 반응군이 7명(16.2%), 비반응군이 10명 (23.2%)이었다. 보조 방사선 치료(p = 0.242)와 호르몬 치료(p = 0.160)에서 반응군과 비반응군 사이에 유의한 차이는 보이지 않았다(Table 3).
Cisplatin, etoposide 항암요법과 다른 항암요법과의 상관관계
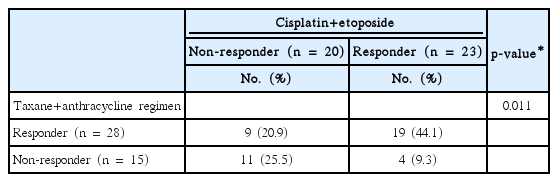
Taxane, anthracycline 항암에 효과가 있었던 환자는 28명(65.1%)으로 taxane, anthracycline 요법으로 4차 이상 항암을 진행하였다. Taxane, anthracycline 요법에 반응이 좋은 28명 중 cisplatin, etoposide 항암화학요법에 반응이 좋았던 치료 반응군은 19명(44.1%)이었고, cisplatin, etoposide 항암 비반응군은 9명(20.9%)이었다. Taxane, anthracycline 항암 후 반응평가에서 치료 실패로 항암을 변경하여 taxane, anthracycline 항암을 3차 이하로 시행한 환자는 15명(34.8%)이었고, 이들 중 cisplatin, etoposide 반응군은 4명(9.3%), 비반응군은 11명(25.5%)이었다.
본 연구에서 43명 중 23명의 환자에서 부분 반응과 안정성 질환을 보여 반응률은 53.5%였다. 후향적으로 분석된 43명의 환자 중 cisplatin, etoposide 요법에 반응이 좋았던 23명의 환자는 평균 6± 2.7회(범위, 1–12회)의 taxane, anthracycline 항암요법을 시행하였고 cisplatin, etoposide 항암요법은 6± 2.8회(범위, 4–16회) 시행받았다. 반면 cisplatin, etoposide 항암화학요법에 반응이 좋지 않았던 20명의 환자는 평균 4± 3.1회(범위, 2–7회)의 taxane, anthracycline 항암 치료 후 cisplatin, etoposide 항암화학요법은 2± 0.6회(범위, 1–3회) 시행하였다. 따라서 Taxane, anthracycline 항암화학요법 후 반응평가에서 결과가 좋았던 환자는 cisplatin, etoposide 항암화학요법에서도 좋은 반응을 보였다(p = 0.011) (Table 4).
Taxane, anthracycline 요법이 실패한 환자들은 다른 항암화학요법(Gemzar, Navelbine, cyclophosphamide, methotrexate, 5-fluorouracil [CMF], Xeloda, Genexol-PM)으로 변경하여 치료를 진행하였다. Cisplatin, etoposide 요법에 반응이 좋았던 치료 반응군에서 Gemzar, Navelbine, CMF, Xeloda, Genexol-PM 항암치료요법에서 반응이 좋았는지 살펴보았을 때 유의한 차이를 보이지 않았고 치료 비반응군에서도 유의한 상관관계를 보이지 않았다(Table 5).
Taxane, anthracycline 요법이 실패하여 다음 항암으로 cisplatin, etoposide 항암화학요법으로 치료를 한 경우(2nd line chemotherapy)와 taxane, anthracycline 요법 실패 후 Gemzar, Navelbine, CMF, Xeloda, Genexol-PM의 다른 항암화학요법으로 치료 후 치료실패로 3번째(3rd line chemotherapy), 4번째(4th line chemotherapy), 5번째 (5th line chemotherapy), 6번째(6th line chemotherapy) cisplatin, etoposide를 사용한 환자들을 대상으로 cisplatin, etoposide 항암 순서에 따른 무진행 생존율을 비교해 보았을 때 유의한 차이는 보이지 않았다(p = 0.372) (Figure 1).
고 찰
미국국립암역학조사(National Cancer Institute’s Surveillance,Epidemiology and End Results)에 따르면 2010년 미국의 유방암 환자 71,983명중 4기환자는 3,205명으로 발생률은 4.4%이다[18]. 전이성 유방암의 치료는 수술, 항암화학요법, 방사선 치료 등의 방법이 있으나[4,11], 다양한 치료 방법에도 불구하고 전이성 유방암 환자의 평균생존기간은 15개월에서 20개월이며[13] 예후가 좋지 않아 4기 유방암 환자의 경우 5년 생존율이 44.1%로 유방암으로 인한 사망률의 대부분을 차지한다[2]. 여러 연구를 통해 전이성 유방암의치료에 anthracycline과 taxane 계열 항암화학요법이 효과적이라는것이 밝혀져 전이성 유방암의 1차 치료약제로 사용되고 있고 향후치료 약제로 다양한 항암제가 거론되고 있다. 본 연구에서는 taxane,anthracycline 항암화학요법 후 cisplatin, etoposide 항암화학요법을 사용한 환자들을 분석해보았다. Taxane, anthracycline 항암화학요법 후 반응평가에서 결과가 좋았던 환자군은 cisplatin, etoposide항암화학요법에서도 좋은 반응을 보였다. 본 연구에서 항암화학요법을 시행한 43명 중 23명의 환자에서 cisplatin, etoposide 항암화학요법에 반응률은 53.5%였다. 이는 Fried 등[19]이 27명의 anthracycline으로선행 항암을 한 전이성 유방암 환자를 대상으로 cisplatin,etoposide 요법으로 항암화학치료를 한 것과 비슷한 결과를 보였다. Fried 등[19]은 27명의 환자 중 독성으로 항암을 중단한 1명을제외한 26명 중 13명에서 cisplatin, etoposide 항암화학요법에 좋은결과를 보였고 반응률은 50%라고 보고하였다.
Franciosi 등[20]의 연구에서는 1차 항암화학치료로 cisplatin,etoposide를 시행 받은 환자군에서 반응률 50%로 두 번째, 세 번째차수로 cisplatin, etoposide 항암요법을 시행 받은 환자들에 비해 반응률이 좋았다. Cisplatin, etoposide 항암요법을 빨리 사용하는 것이반응률이 좋은 것을 고려해 보았을 때[13,16,21], 본 연구에서는 cisplatin,etoposide 항암 시작 차수에 따른 통계적인 유의성은 보이지않았다(Figure 1). 이는 본 연구의 전체 환자군이 43명으로 적었고, 두 번째 요법으로 항암을 시행한 환자가 4명으로 적어 변별력을 주지 못하였다.
본 연구에서 cisplatin, etoposide 항암화학요법의 치료 반응군에서 삼중음성유방암 환자가 7명, 비반응군에서는 4명으로 치료 반응군에서 삼중음성유방암 환자가 더 많은 경향을 보였으나 통계적으로 유의하지는 않았다. Platinum계 항암화학요법이 삼중음성 유방암에서 효과적이나 Tian 등[22]의 연구에서 platinum계 항암화학요법을 시행 받은 삼중음성유방암 환자의 생존율을 완전히 평가하려면 더 많은 임상시험이 필요하다고 하였고 본 연구가 통계적으로유의하지 않은 것은 전체 환자수가 적었기 때문에 충분한 비교를 하지 못했다고 생각한다.
본 연구의 제한점은 후향적으로 단일기관에서 시행하여 대상 환자수가 43명으로 적다는 것이다. 또 다른 제한점으로는 환자들이호소하는 부작용이나 삶의 질에 대한 두 군 간의 비교가 이루어 지지 않았다는 것이며 이는 본 연구가 후향적으로 진행되어 분석이 이루어 질 수 없었다. 향후 많은 환자를 대상으로 전향적 연구가 필요할 것으로 생각된다.
저자들은 taxane, anthracycline 항암치료에 실패한 전이성 유방암 환자들이 치료 실패로 다른 항암화학요법으로 변경할 경우 cisplatin,etoposide 항암요법과의 연관성 및 치료 결과에 대한 예측을 보여주고자 하였다. Taxane, anthracycline 항암화학요법에 반응이좋았던 전이성 유방암 환자에서 치료 실패 후 cisplatin, etoposide 항암화학요법으로 변경시 좋은 효과를 보일 것으로 예상된다.
Notes
The authors declare that they have no competing interests.