전신치료 후 장기간 종양의 유지를 보이는 전이성 유방암 환자의 임상적 특징
Factors Associated with Metastatic Breast Cancer in Patients Who Show Long-Term Stable Disease Status
Article information
Trans Abstract
Purpose
This study aimed to analyze the basic clinical characteristics and survival of patients with breast cancer whose disease had been stably maintained for more than 24 months after systemic therapy.
Methods
We retrospectively reviewed the medical records of patients with primary breast cancer who underwent surgery. Among these patients, patients with stage IV disease at diagnosis or those who developed distant metastasis during the follow-up period after surgery were included in this analysis. Patients whose disease remained stable for more than 24 months were classified as the long-term stable disease group. The remaining patients were classified as the control group.
Results
A total of 245 patients were eligible for this analysis. Patients in the long-term stable disease group showed a lower rate of histologic type III, a higher rate of hormone receptor positivity, and received less adjuvant chemotherapy. In the long-term stable disease group, the most frequent site of metastasis was the lungs, whereas in the control group, it was the bones. Overall survival was significantly better in the long-term stable disease group than in the control group (p<0.001). In univariate analysis, factors affecting the overall survival rate were the duration from diagnosis to metastasis, the absence of lymphatic infiltration, and the presence of hormone receptors. In multivariate analysis, the duration from diagnosis to metastasis and the absence of lymphatic infiltration were significant factors affecting the overall survival rate.
Conclusion
Disease progression was observed in many patients even after the disease had been stable for more than 24 months after systemic therapy. Although these patients had better outcomes compared with the others, continuous observation and possible additional treatment might be helpful for some patients.
서 론
전이성 유방암 환자의 평균 수명은 약 2–4년 정도로 알려져 있다[1]. 그러나 최근 여러 치료법의 발달에 힘입어, 원격 전이된 경우도 생존율이 많이 향상되었다. 드물게는 진단 후 18년 이상까지 장기 생존하는 경우도 보고 되었다[2]. 하지만 이렇게 장기 생존하는 환자들의 치료와 추적관찰에 대한 임상적 지침은 거의 없다. 특히 특정 약물을 사용하여 장기간 안정 병변(stable disease)이 유지되는 경우 이 약물을 언제까지 사용하여야 할지에 대한 결정은 의사와 환자 모두에게 매우 어려운 일이다.
전이 유방암의 치료는 종양의 분자생물학적 특성과 환자의 전신 건강 상태를 고려하여 호르몬요법, 항암화학요법, 표적치료 중 적절한 약제를 선택하여 시행한다.
항암화학요법을 장기간 투여 시 무진행 생존기간이 연장되지만 전체 생존기간의 이익은 없는 것으로 알려져 있다[3]. 장기간 항암화학요법을 투여하는 것이 정해진 횟수의 항암화학요법을 투여하고 중단하는 것보다 암 진행과 사망을 감소시키는 효과가 있으나, 항암화학요법의 독성과 환자의 삶의 질을 고려하여 보면 모든 환자에게 이를 일괄적으로 적용하기는 어렵다[4].
호르몬요법과 표적치료의 발달로 인해 호르몬수용체 양성 또는 human epidermal growth factor receptor 2 (HER2) 양성 유방암의 경우 질병의 진행을 효과적으로 억제하며 항암화학요법에 비하여 독성이 낮은 약제를 장기간으로 사용하기 좀 더 용이하게 되었다[5]. 그러나 타목시펜은 폐경 증상, 안 독성, 혈전증, 자궁내막암의 부작용이 나타날 수 있다[6]. 아로마타제 억제제는 골다공증과 골절의 위험도가 증가하며 관절통 등의 근골격계 및 관절증상 등이 환자의 순응도를 떨어뜨린다[7]. 현재 임상에서 HER2 양성 유방암 환자에게 사용되는 대표적인 표적치료제인 trastuzumab은 HER2 양성 유방암에서 전체 생존율의 획기적인 진전을 가져왔지만 부작용으로 심독성을 일으킬 수 있어 투여 시 주의를 요한다[8]. 또 다른 표적 치료제로 mechanistic target of rapamycin (mTOR) 억제제의 하나인 everolimus는 아로마타제 억제제와의 병용요법에서 임상적 유용성을 보여주었으나 구강 궤양, 고혈당 등으로 지속 치료가 쉽지 않다[9,10]. 이에 더하여 약물의 치료 효과를 판단하기 위하여 2–4개월 마다 전산화 단층 촬영(computed tomography, CT) 등 고가의 영상학적 검사가 필요하다[10]. 따라서 전이성 유방암 환자에서는 위와 같은 부작용으로 인하여 생기는 환자의 삶의 질 저하와 의료비, 환자의 생존기간 연장 등을 복합적으로 고려하여 치료 방법과 기간을 결정해야 한다.
본 연구에서는 장기간 종양의 유지(stable disease)를 보이는 전이성 유방암 환자들의 임상적인 특성과 무진행 생존율(progression-free survival), 전체 생존율(overall survival)에 미치는 요인들을 분석하였다.
대상 및 방법
대상 환자
2004년 1월부터 2012년 12월까지 한국원자력의학원에서 원발성 유방암으로 근치적 수술을 받은 후 추적관찰 중에 원격 전이가 진단되었거나 유방암 진단 시부터 원격 전이가 동반된 환자를 대상으로 하였다. 이 중 반대편 유방에 이차성 유방암이 발생한 환자, 유방암 외에 원발암으로 진단된 환자, 유방암 이외의 다른 이유로 사망한 환자, 전이 이후 2개월 이상의 추적관찰이 불가능했던 환자, 엽상 종양 환자, 재발 후 전신적 치료(systemic therapy)를 시행하지 않은 환자 427명을 제외하고, 최종 245명이 본 연구에 포함되었다.
근치적 수술 시행 후 추적관찰을 시행하였으며, 진단 당시 전이가 확인된 경우 출혈, 괴사가 있거나 이와 같은 증상이 나타날 것이 예상되는 환자를 대상으로 병변과 증상의 조절을 위해 고식적 수술이 시행되었다. 수술 후 5년까지는 6개월 간격으로 혈액 종양표지자검사, 유방촬영술, 유방초음파, 복부 및 흉부 CT, 골스캔을 시행하였다. 5년 이후에는 1년 간격으로 추적관찰을 시행하였다. 원격 전이가 발견된 이후에는 2–3개월 간격으로 혈액 종양표지자 검사, 유방촬영술, 유방초음파, 흉부 및 복부 CT, 골스캔 중 환자의 전이 부위와 치료 일정에 따라 선택하여 추적관찰을 시행하였다.
수술 후에 항암화학요법 시행 중에 전이가 발생하였던 환자들은 보조 호르몬요법을 받지 못하였다. 진단 시에 전이가 발생되었던 환자 역시 보조 호르몬요법을 시행 받지 못하였다. 따라서 67명의 환자만이 근치적 수술 후 보조 호르몬요법을 시행 받았다.
전신전이가 진단되고 전신적 치료를 받은 후 한 번이라도 24개월을 초과하여 안정 병변으로 유지된 환자를 장기 안정 환자군(long-term stable disease group)으로 정의하였으며 그 외의 모든 환자를 대조군으로 정의하였다.
자료 수집
유방암으로 진단받고 수술을 시행 받은 환자들의 의무기록과 병리 자료를 바탕으로 조사하였다. 수술 방법, 수술 당시의 나이, TNM 병기, 조직학적 등급, 호르몬수용체, HER2 발현 유무, Ki-67 발현 유무, 수술 후 시행한 보조 치료, 전이장기 등 원발 종양의 임상병리학적인 특징을 후향적으로 분석하였다. 에스트로겐 수용체 혹은 프로게스테론 수용체 양성인 경우를 호르몬수용체 양성으로 정의하였다. HER2 양성은 면역조직화학염색에서 3+인 경우로 정의하였다. HER2가 면역조직화학염색에서 2+인 경우 fluorescence in situ hybridization (FISH) 또는 silver-enhanced in situ hybridization (SISH)에서 HER2/CEP17 비율이 >2.2인 경우를 양성으로 정의하였다.
본 연구는 한국원자력의학원 임상연구 윤리심의위원회의 승인을 받았다(K-1605-002-015).
통계 방법
장기 안정 환자군과 그 외의 대조군 사이에 임상병리학적인 차이는 Pearson chi-square test와 Student t-test를 이용하여 분석하였다. 무진행 생존율과 전체 생존율은 Kaplan-Meier 방법을 이용하여 분석하였다. 전체 생존율에 영향을 미치는 요소는 log-rank test로 비교하였으며 이 분석에서 의미 있는 변수를 이용하여 Cox proportional hazard model을 통해 다변량 분석을 시행하였다. 모든 통계적 분석은 p-value <0.05를 통계적으로 의미 있는 값으로 보았다.
결 과
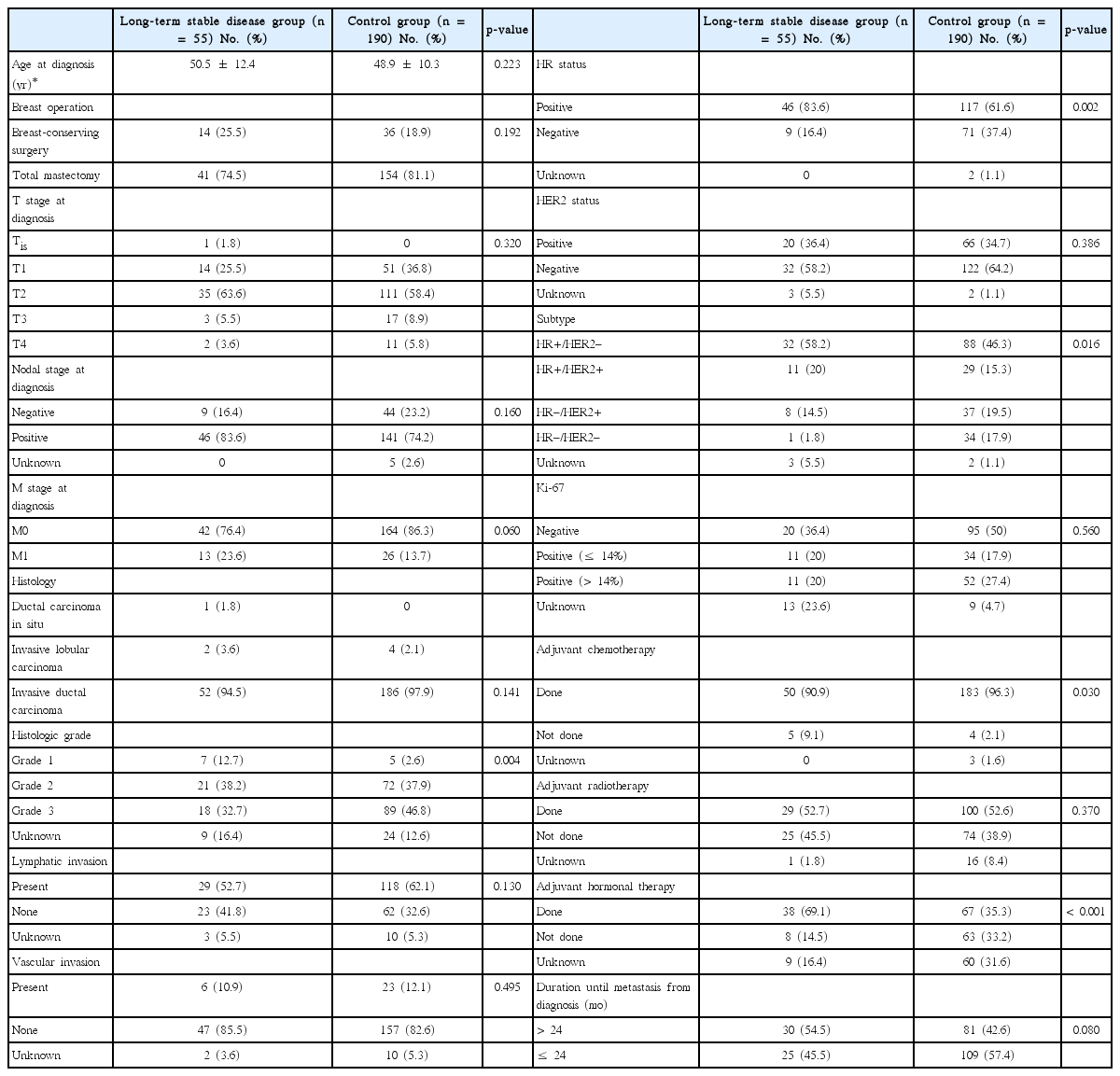
장기 안정 환자군은 55명이었으며 대조군은 190명이었다. 유방암 진단 당시의 나이(p=0.223), 유방암 진단 후 시행한 근치적 절제 수술의 종류(p=0.192), 원발 종양의 크기(p=0.320), 림프절 전이 여부(p=0.160), 수술 당시의 타 장기 전이 여부(p=0.060)는 장기 안정 환자군과 대조군 사이에 차이가 없었다. 또한 유방암 진단 당시 원격 전이의 동반은 장기 안정 환자군에서 많은 비율을 보였으나 통계적인 유의한 차이는 보이지 않았다.
장기 안정 환자군의 조직학적 분화도 III인 환자는 18명(32.7%), 대조군의 조직학적 분화도가 III 인 환자는 89명(46.8%)으로 대조군에서 조직학적 분화도가 III인 환자가 높은 비율을 보였다(p=0.004). 장기 안정 환자군에서 호르몬수용체가 양성인 환자는 46명(83.6%), 대조군의 호르몬수용체가 양성인 환자는 117명(61.6%)으로 장기 안정 환자군에서 호르몬수용체 양성인 환자의 비율이 더 높았다(p=0.002). 반면 HER2 과발현 여부(p=0.386)와 Ki-67 수치(p=0.560)는 장기 안정 환자군과 대조군에서 차이를 보이지 않았다. 근치적 수술 시행 2년 이후 전이가 진단된 경우는 장기 안정 환자군에서 54.5%로 대조군 42.6%과 통계학적인 차이가 없었다(p=0.080) (Table 1). 본 논문에서는 진단 시 전이가 있던 환자와 치료 중 전이가 있었던 환자를 같이 분석하였다. 그 이유는 본 연구의 목적이 원격 전이가 있는 환자에게서 약물치료를 하였을 때 장기 안정 환자의 특성을 보고자 하였기 때문에 두 군의 환자를 모두 포함시켰다. 통계적 분석에서도 Table 1에 나타난 바와 같이 두 군 간의 통계학적으로 유의한 차이는 관찰 할 수 없었다.
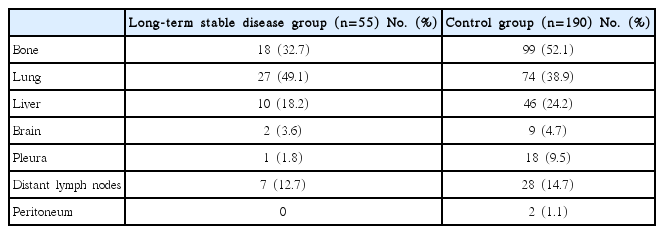
전이 장기별 분류로 장기 안정 환자군에서는 폐전이가 가장 많은 27명(49.1%), 그 다음으로 뼈전이 18명(32.7%)이 많았다. 대조군에서는 뼈전이가 가장 많은 99명(52.1%), 그 다음으로 폐전이 74명(38.9%), 간전이 46명(24.2%)의 순이었다(Table 2).
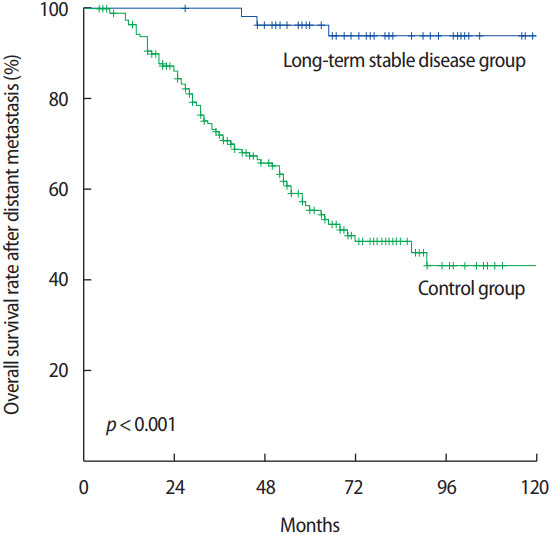
평균 무진행 생존율은 67.3개월이었고 중앙값은 69.0개월이었다(Figure 1). 장기 안정 환자군에서 24개월 이상 장기 안정 시 사용한 전신 약물을 시작한 시점부터 무진행 생존 곡선을 확인하여 보았다. 환자들은 2년간 장기 안정 후에도 지속적인 질병의 진행을 보였으며 이러한 경향은 이 후 60개월까지도 지속되었다. 원격 전이 진단 후 전체 생존율에서는 장기 안정 환자군이 대조군에 비하여 좋은 전체 생존율을 보였다(p<0.001) (Figure 2).
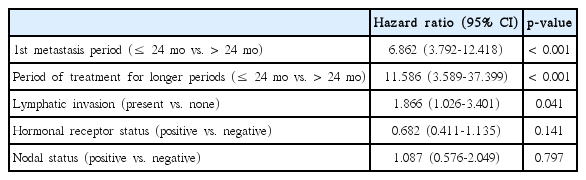
수술 후 첫 번째 전이가 진단 된 시기가 24개월 이상인 경우(p<0.001), 병변의 장기 안정 상태가 24개월 이상 유지된 경우(p<0.001), 림프관 침윤이 없는 경우(p=0.041), 호르몬수용체 양성인 경우(p<0.001)가 통계학적으로 유의하게 전체 생존율이 좋았다(Table 3).
단변량 분석에서 의미 있었던 인자로 다변량 분석을 시행하였다. 수술 후 첫 번째 전이가 진단 된 시기(hazard ratio, 6.862; 95% confidence interval [CI], 3.792–12.418; p<0.001), 병변의 장기 안정 상태가 24개월 이상 유지된 경우(hazard ratio, 11.586; 95% CI, 3.589–37.399; p<0.001), 림프관 침윤이 없는 경우(hazard ratio, 1.866; 95% CI, 1.026–3.401; p=0.041)가 전체 생존율에 좋은 영향을 미치는 독립적인 변수로 확인되었다(Table 4).
고 찰
본 연구에서 2년 이상 장기 안정 병변으로 유지된 장기 안정 환자군은 대조군에 비해서 전체 생존율은 좋았으나, 장기적으로는 병의 진행이 지속적으로 관찰되었다. 이와 같이 장기 안정 환자군의 전체 생존율이 높은 이유는 유방암 재발 후 24개월 이상 종양의 유지를 보인 환자들은 호르몬수용체 양성, HER2 음성을 보이는 경우가 많기 때문이었을 것이다. 이러한 환자는 생존율이 좋은 것으로 이미 알려져 있다[11-14]. 또한 호르몬요법은 항암화학요법에 비하여 독성이 적어 몇 년간의 장기적 치료도 가능하기 때문에 이런 환자에서 생존율이 증가하는 데 도움이 되었을 것이다[5].
본 연구에서의 특이한 점은 장기 안정 환자에서의 전이 장기 중 폐전이가 가장 많았다는 것이다. 일반적으로 유방암의 일차 치료 후 재발 환자의 전이 장기는 뼈전이가 가장 많으며 폐전이가 있을 경우 뼈전이에 비하여 예후가 안 좋다고 알려져 있다[15-17]. 그러나 본 연구에서는 장기 유지 환자군에서 차지하는 비율이 폐전이, 뼈전이, 림프절전이의 순으로 나타나 폐전이 환자가 상대적으로 높은 생존율을 보였다. 이와 같은 결과는 지금까지 알려진 내용과는 다른 것으로 그 이유는 명확하지 않으나 최근 급속히 발달한 유방암 전신치료 약물에 힘 입었을 가능성이 있다. Gerratana 등[18]이 최근 발표한 바에 의하면 첫 번째 유방암의 원격 전이가 폐전이인 경우에는 전이 후 생존기간은 58.5개월로 가장 좋은 예후를 보였고, 뼈전이의 경우 44.4개월로 두 번째였다. 그 뒤로 간전이인 경우가 36.7개월, 뇌전이인 경우가 7.35개월로 보고하여 본 연구 결과와 일치하였다. 이는 호르몬요법이나 항 HER2 요법 같은 각 환자에 따른 맞춤 치료 가 발달하면서 호르몬수용체와 유방암의 분자 생물학적 특징에 따라 환자의 생존율의 발전 속도 차이에 힘입었을 가능성이 높다[19]. 이와 더불어 원격 전이된 장기에 따라서도 시대에 따른 치료 성적의 발전 속도에 차이가 있다는 보고가 있는데, 아마도 이것이 본 연구에서 폐전이 환자가 장기 생존율이 높았던 이유일 수 있다. Munich Cancer Registry의 35년간의 장기 보고에 따르면 치료 발달에 의한 효과는 뼈전이, 간전이, 뇌전이에 비하여 폐전이에서 두드러지게 향상되었다[20].
지속적인 항암화학요법을 받는 환자들에서는 피로, 오심, 구토, 골수억제, 신경염, 탈모와 같은 부작용이 발생하는 경우가 많다[21,22]. 또한 항암화학요법에 의한 독성 발생이 심한 경우에는 환자의 전신 상태 악화로 인해 치료를 중단하거나 약물을 바꾸어야 하는 경우도 있다. 그리하여 수술 후 타 장기 전이 발견 후 장기 안정 병변을 가진 환자와의 상담에서 치료 또는 검사를 중단하기를 요구하는 경우가 많다. 하지만 이러한 환자들에 대해 치료기간에 대한 연구가 부족해 명확한 치료기간에 대한 제시가 어려웠다.
본 연구를 통해 장기간 안정 병변을 유지한 환자군은 대조군에 비해 전체 생존율이 높음을 알 수 있었고, 또한 병의 진행 가능성도 있으므로 추적관찰 시 장기적으로 치료와 검사가 필요함을 설명 할 수 있다는 점에서 본 연구의 가치는 크다고 볼 수 있다.
본 연구의 제한점은 후향적인 연구로 단일 기관에서 시행되었기 때문에 대상 환자수가 많지 않다는 것이다. 그러나 이와 같이 발생 빈도가 높지 않은 2년 이상 장기 안정 병변을 가지는 환자를 상대적으로 긴 추적관찰 기간을 분석하여 특성을 보는데 임상적 의의가 크다. 또 다른 제한점은 유방암 전이 후 환자들에 대한 삶의 질 평가가 이루어지지 않았다는 것이다. 이 또한 본 연구가 후향적 자료 분석으로 진행되었기 때문에 평가되지 않았던 항목에 대한 분석이 이루어질 수 없었다. 추후 많은 환자들을 대상으로 이에 대한 전향적 연구가 필요할 것으로 생각된다.
본 연구에서 전이 발견 후 2년 이상 장기간 안정 병변이 유지 되었어도 그 이후에는 병의 진행이 지속적으로 계속되었다. 이 환자들의 전체 생존율은 다른 환자에 비하여 상대적으로 좋았으나 지속적인 추적관찰과 연속적인 치료가 지속되어야 할 것으로 생각된다.
Acknowledgements
This study was supported by a grant of the Korea Institute of Radiological and Medical Sciences (KIRAMS), funded by Ministry of Science, ICT and Future Planning, Republic of Korea (1711045543/50462-2017).
Notes
The authors declare that they have no competing interests.