림프절 양성 유방암의 선행항암화학요법 후 잔여 액와부 림프절 전이의 예측 인자
Predictive Factors of Residual Metastatic Axillary Lymph Nodes after Neoadjuvant Chemotherapy in Node-Positive Breast Cancer
Article information
Trans Abstract
Purpose
Sentinel lymph node biopsy (SLNB) has been a reliable technique in breast cancer staging. However, some authors reported that SLNB after neoadjuvant chemotherapy (NAC) could lead to low identification rates and high false-negative rates. Hence, whether only SLNB can be applied after NAC is controversial. The aim of this study was to identify predictive factors of residual metastatic axillary lymph nodes after NAC.
Methods
In this study, 71 breast cancer patients with clinically positive lymph nodes (cN1), who received axillary lymph node dissection (ALND) after NAC between July 2012 and September 2014, were enrolled. The patients were divided into N1 and N0 groups according to the presence of residual axillary metastatic lymph nodes after ALND. We compared the clinical, radiological, and immunohistological factors between two groups.
Results
In the 71 patients with cN1who received NAC, N1 and N0 status were confirmed after surgery in 43 and 28 patients, respectively. The clinical stage at diagnosis was IIA in one patient, IIB in 15 patients, IIIA in 35 patients, IIIB in two patients, IIIC in 10 patients, and IV in eight patients. Most of the patients (n=57) received eight cycles (four cycles of anthracycline and four of taxane) of chemotherapy. Our study showed that the primary tumor was downstaged in 58 of the 71 patients (81.7%). Sixteen patients (22.5%) had pathological complete response (pCR) and 42 (59.2%) had pathological partial response. In a multivariate analysis, tumor response and human epidermal growth factor receptor 2 (HER2) were identified as significant factors. However, no significant differences were observed in the results of postchemotherapy ultrasonography, and pre- or post-positron emission tomography computed tomography (maximum standardized uptake value reduction).
Conclusion
In the NAC setting, SLNB before ALND is feasible for tumors predicted to have a pCR or if target therapy had been administered for HER2-positive breast cancer.
서 론
선행항암화학요법은 항암제의 효과를 미리 평가해 볼 수 있으며, 유방보존술이 가능하게 하는 이점을 가지고 있어 국소 진행성 유방암 환자의 치료에 널리 이용되고 있다.
감시림프절 생검은 임상적 액와림프절 음성 환자에서 림프절 전이 여부를 확인할 수 있는 신뢰할 만한 방법이나, 임상적 액와림프절 전이 양성 환자에 있어 선행항암화학요법 후 시행되는 감시림프절 생검의 신뢰성에 대해서는 논란이 있었다. 여러 연구에서 선행항암화학요법 후 감시림프절 생검에 있어 발견율이 낮고 위음성률이 높다고 보고하였다[1-4]. 이런 이유로 임상적 액와림프절 전이 양성 환자에서 선행항암화학요법 후 감시림프절 생검 시행에 주의를 요한다는 것이 보편적인 견해이다.
임상적 액와림프절 전이 양성 환자에서 선행항암화학요법 후 감시림프절 생검의 결과가 액와림프절곽청술의 시행 여부에 중요한 역할을 한다. 만약 액와림프절 전이를 예측할 수 있는 중요한 인자가 있다면 감시림프절 생검 결과와 더불어 액와림프절곽청술의 시행 여부를 결정하는 데 중요한 역할을 할 것이다. 이 연구를 통해 선행항암화학요법 후 잔여 액와림프절 전이를 예측할 수 있는 인자들을 알아보고자 했다.
방 법
대상
본 연구는 2012년 8월부터 2014년 10월까지 칠곡 경북대학교병원과 대구파티마병원에서 임상적 액와림프절 전이 양성으로 선행항암화학요법을 시행 후 유방절제술 및 액와림프절곽청술을 시행 받은 71명의 환자를 대상으로 하였고, 대구파티마병원 임상시험위원회의 승인(DFE16ORIO010)을 받아 후향적으로 분석하였다. 임상적 액와림프절 전이 양성은 수술 전 이학적 검사, 초음파, 양전자방출단층촬영(positron emission tomography/computed tomography, PET/CT), 자기공명영상(magnetic resonance imaging, MRI)을 통해 평가하였고, 평가가 애매한 일부의 환자에서는 세침흡인검사를 통해 확인하였다. 선행항암화학요법 후, 생체염료와 방사성 동위원소의 이중 검사법을 이용한 감시림프절 생검을 우선 시행한 7명의 환자를 제외하고 나머지 64명의 환자에서는 감시림프절 생검 시행 없이 액와림프절곽청술을 시행하였다. 71명의 환자를 수술 후 병리조직학적 결과에 따라 43명의 림프절 전이 양성군과 28명의 림프절 전이 음성의 두 군으로 분류하였다.
선행항암화학요법과 치료반응
항암 치료는 doxorubicin 60 mg/m2과 cyclophosphamide 600 mg/m2 (AC) 4회 또는 AC 4회와 docetaxel 100 mg/m2 4회의 병합요법이 가장 많았고(N1군 37명, N0군 25명), weekly paclitaxel 80 mg/m2은 4기로 진단된 8명의 환자에서 사용되었다. 수술 전 human epidermal growth factor receptor 2 (HER2) 양성으로 확인된 환자들은 선행항암화학요법과 표적치료를 병행하였고 선행항암화학요법의 치료 반응은 치료 중, 후에 각각 초음파, 자기공명영상, 양전자방출단층촬영을 통해 평가하였다. 부분 관해는 모든 표적 병변의 장경 합이 30% 이상 감소, 완전 관해는 관찰되었던 모든 표적 병변의 소실 및 병리학적 림프절이 10 mm 미만으로 감소했을 때로 정의하였다.
수술적 치료와 비교 인자
선행항암화학요법 후 영상의학적 검사를 바탕으로 다학제 논의를 통해 수술의 범위를 결정하였다. 이 연구에 포함된 8명의 4기 환자들은 유방 변형으로 인해 삶의 질에 심각한 문제를 일으켜 환자와 충분한 의논을 거쳐 고식적 치료를 시행하였다. 항암 치료 후 액와림프절 전이의 완전 관해로 추정되는 7예에서 감시림프절 생검을 우선 시행하였고, 비록 선행항암화학요법 후에 종양의 크기가 감소했다 하더라도 액와림프절 전이가 남아 있는 것으로 판단되었을 경우에는 감시림프절 생검을 거치지 않고 바로 액와림프절곽청술을 시행하였으며, 액와림프절 절제의 범위는 level II까지 시행하였다.
임상적 액와림프절 전이 양성인 환자에서 선행항암화학요법 후 잔여 액와림프절 전이 여부를 예측할 수 있는 인자를 알아보기 위해 두 군 간의 선행항암화학요법의 종류, 치료 반응, 병기, 에스트로겐 수용체(estrogen receptor, ER), 프로게스테론 수용체(progesterone receptor, PR), HER2, Ki-67, 항암 화학요법 후 초음파, 항암 화학요법 전, 후의 양전자 단층촬영(maximum standardized uptake value, SUVmax) 등을 비교 분석하였다.
통계학적 분석
예측 인자를 알아보기 위해 독립표본 t-검정, 카이제곱 검정(chi-square), Fisher의 정확한 검정을 이용하여 두 군을 비교하였고, 다항 로지스틱 회귀분석을 이용하여 의미가 있는 인자를 확인하였다. p<0.05인 경우에 통계학적 의의가 있는 것으로 정의하였으며, 통계학적 분석은 IBM SPSS version 21.0 (IBM Corp., Armonk, USA) 프로그램을 이용하였다.
결 과
임상적 액와림프절 전이 양성으로 선행항암화학요법을 시행한 71명의 환자 모두에서 액와림프절곽청술을 시행하였고, 수술 후의 병리조직학적 검사 결과에 따라 잔여 액와림프절 전이가 있는 군(N1, 43명)과 잔여 액와림프절 전이가 없는 군(N0, 28명)으로 분류하였다.
종양의 크기는 N1군 5.6±2.7 cm, N0군 5.6±2.8 cm였고(p=0.915), 조직학적 등급은 두 군 모두 grade 2가 가장 많았다(72%, 85.7%). 병기는 N1군에서 IIIA 19명(44.2%), IIB 10명(23.3%) 순으로 많았고, N0군에서는 IIIA가 16명(57.1%)으로 가장 많았다(p= 0.597). 수술 전 액와림프절 전이 여부의 평가는 N1군에서 영상의학적 검사만 시행한 경우가 16명, 세침흡인검사를 추가로 시행한 경우가 27명(62.8%)이었고, N0군에서는 영상의학적 검사는 14명, 세침흡인검사는 14명이었다. 유방 종양에 대한 수술 방법은 N1군에서 유방보존술 3명, 유방절제술 40명(93.0%)이었고, N0군에서는 유방보존술 4명, 유방절제술이 24명(85.7%)이었다. 제거된 액와림프절 수는 N1군에서 16±6개, N0군에서 14±8개로 통계학적 차이는 없었다(p=0.188) (Table 1).
하지만, 분자 아유형에 따른 분류에서는 N1군에서 Luminal A가 17명(39.5%)으로 가장 많이 차지하였고, N0군에서는 Luminal B (HER2) 9명(32.1%), HER2 양성 8명(28.6%) 순으로 많았으며 통계학적 의의가 있었다(p=0.018). HER2는 N1군에서 11명(25.6%), N0군에서 18명(64.3%)이 양성이었다(p=0.001). 수술 전 HER2 양성으로 확인된 N1군 11명과 N0군 18명은 모두 표적치료(trastzumab)를 시행 받았다. 그 외 Ki-67, ER, PR, tumor marker (CEA, CA15-3)에 따른 통계학적 차이는 없었다. 선행항암화학요법 약제는 AC와 docetaxel 병합요법이 N1군에서 34명(74.9%), N0군에서 23명(82.1%)으로 가장 많았다. 치료 반응을 보면 전체 71명 중에서 58명(81.7%)이 원발 종양의 크기가 감소했는데, N1군에서는 완전 관해가 4명(9.3%), 부분 관해가 28명(65.1%)이었고, N0군에서는 완전 관해 12명(42.9%), 부분 관해 14명(50.0%)으로 N0군에서 더 나은 치료 반응을 보였다(p=0.003). 항암 치료 후 양전자 단층촬영(SUVmax)의 비교는 독립표본 t-검정을 이용한 방법을 이용하여 N1군에서 1.681±2.210, N0군에서 0.714±0.439로(p=0.008) 통계학적 유의성을 보였으나 SUVmax 2.5를 기준으로 한 Fisher 검정에서는 SUVmax <2.5인 경우는 N1군에서 38명(88.4%), N0군에서 28명(100.0%)으로 거의 모든 환자가 해당하여 통계학적 유의성을 보이지 않았다(p=0.149) (Table 1).
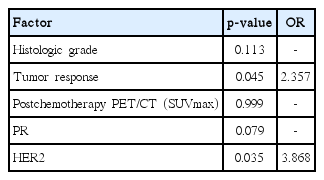
N1군에서 병리조직학적으로 완전 관해로 확인되었던 4명은 삼중음성 유방암(triple negative breast cancer) 1명, HER2 2명, Luminal B 1명이었으며, N1군에서 1예에서 감시림프절 생검 결과가 음성이었으나 액와림프절곽청술을 시행 후 전이 양성으로 확인되었다. 이 환자는 종양의 크기 4.8 cm, 분자 아유형은 Luminal A이었으며 치료 전 세침흡인검사상 액와림프절 전이 양성으로 확인되어 임상적 병기 IIB로 선행항암화학요법(AC 4회와 docetaxel 4회)을 시행하였다. 치료 반응은 부분 관해로 판단되었고, 항암 치료 후 시행한 초음파상에서는 액와림프절의 이상 소견은 관찰되지 않았다. 양전자 방출 단층촬영에서는 항암 치료 전, 후의 SUVmax는 1.4, 0.6이었다. 감시림프절은 2개가 제거되었고 결과는 전이 음성이었으나 액와림프절곽청술을 시행한 결과 22개의 림프절 중 7개에서 전이 양성으로 확인되었다. 로지스틱 회귀분석에 따르면, 잔여 액와림프절 전이를 예측할 수 있는 의미 있는 인자로는 치료 반응(p=0.045; odds ratio [OR], 2.357)과 HER2 양성(p=0.035; OR, 3.868)으로 확인되었다(Table 2).
고 찰
선행항암화학요법은 원발 종양의 크기를 감소시켜 유방보존술을 가능하게 할 수 있고, 항암 치료의 효과를 미리 알아볼 수 있다는 장점이 있어 국소 진행성 유방암 환자의 치료에 이용되고 있으며, 유방 종양의 크기가 5 cm 이상이거나 액와림프절 전이가 확인되었을 경우에 고려해 볼 수 있다. National Surgical Adjuvant Breast and Bowel Project B-18 연구에 따르면 선행항암화학요법을 시행 받은 환자에서 수술 후 항암 요법의 경우에 비해 유방보존술의 비율이 더 높다고 보고한 바 있다[5]. 뿐만 아니라, 임상적 액와림프절 전이 양성으로 선행항암화학요법을 시행 받은 환자의 20%–44%에서 액와림프절 전이의 완전 관해가 보고되기도 했다[6,7]. 본 연구에서도 28명(39.4%)의 환자가 액와림프절 전이의 완전 관해로 확인되었다. 선행항암화학요법 후 시행하는 양전자 단층촬영이 잔여 액와림프절 전이 여부를 예측할 수 있다는 연구들도 있으나[8-11] 본 연구에서는 통계학적 차이는 없는 것으로 나타났다.
감시림프절 생검은 임상적 액와림프절 전이 음성 환자에서 액와림프절의 전이 여부를 판단하는 데 신뢰할 만한 방법으로 널리 받아들여지고 있다. 그뿐만 아니라, 임상적 액와림프절 전이 양성 환자의 경우에도 마찬가지로 선행항암화학요법 후 잔여 액와림프절 전이 여부의 평가에 감시림프절 생검이 신뢰할 만하다는 보고들도 있다[12-16]. 만약, 액와림프절곽청술을 시행하지 않아도 되는 경우를 예측할 수 있다면 불필요한 액와림프절곽청술을 피함으로써 환자의 삶의 질 향상에 큰 도움이 될 것이다. 하지만, 앞서 언급한 바와 같이 여러 연구에서 선행항암화학요법 후 감시림프절 생검을 시행할 경우에 감시림프절의 발견율이 낮아지고 위음성률이 높아진다 보고하였다. 선행항암화학요법 후 감시림프절 생검의 정확성에 있어 감시림프절의 발견율을 높이고 위음성률을 낮추는 것이 중요한데, 앞서 언급한 연구 이외에 몇몇 연구에서도 생체염료와 방사성 동위원소의 이중 검사법을 이용한 경우 발견율을 높일 수 있다고 보고하였다[17,18]. 이와 더불어 본 연구의 결과에서 보여주듯이 HER2 양성으로 표적치료를 시행 받은 경우나 선행항암화학요법 시행 후 원발 종양의 완전 관해가 이루어진 경우에는 액와림프절 완전 관해의 가능성을 고려해야 할 것으로 생각된다.
본 연구의 제한점으로는 환자의 수가 많지 않고, 치료 전 일부 환자에서 영상의학적 검사로만 액와림프절의 전이 여부를 판단하고 액와림프절에 대한 병리조직학적 확인이 없었던 점, 모든 환자에서 일괄적으로 감시림프절 생검을 우선 시행하지 못한 점 등이 있다. 만약 모든 환자에서 진단 당시 액와림프절에 대한 세침흡인검사를 시행하고 수술 시 감시림프절 생검을 시행 후 액와림프절곽청술을 시행했더라면 선행항암화학요법 치료 후 감시림프절 생검의 정확성 또한 확인할 수 있었을 것이고 본 연구의 주제와 관련해서도 좀 더 명확한 예측 인자를 확인할 수 있었을 것으로 생각된다. 뿐만 아니라, 향후 더 많은 수의 환자를 대상으로 선행항암화학요법이 유방 종양과 액와림프절 전이에 미치는 영향을 분리해서 확인하는 추가적 연구가 필요할 것으로 생각된다.
본 연구 결과에서도 나타나듯이 임상적 액와림프절 전이 양성 유방암에서 선행항암화학요법 후 잔여 액와림프절 전이 여부를 예측할 수 있는 명백한 인자는 아직 밝혀지지 않은 것이 사실이다. 하지만, 항암제에 대한 종양의 반응이 완전 관해인 경우와 HER2 양성 유방암으로 표적치료를 시행한 경우에는 액와림프절곽청술의 시행에 앞서 감시림프절 생검을 우선적으로 고려해 볼 수 있을 것으로 판단된다.
Notes
The authors declare that they have no competing interests.