유방암환자에서 아로마타제 억제제 및 칼슘/비타민D 복합제 병용투여의 골다공증 예방효과
Prevention of Osteoporosis in Patients With Breast Cancer Treated With Aromatase Inhibitor Combined With Calcium/Vitamin D Supplements
Article information
Trans Abstract
Purpose
Tamoxifen and aromatase inhibitor (AI) are used for hormone therapy for hormone-positive breast cancer, and AI is well known to decrease bone mineral density (BMD). The authors compared the serial BMD of patients with hormone-positive breast cancer to evaluate the preventive effect of AI combined with calcium and vitamin D (Ca/Vit D) supplements.
Methods
A total of 249 women with hormone-positive breast cancer who underwent serial BMD assessments between 2011 and 2015 were included. The patients were classified as the tamoxifen alone group (n=23), AI with Ca/Vit D group (n=139), and extended regimen from tamoxifen to AI with Ca/Vit D group (n=87). Moreover, osteoporosis was diagnosed based on the World Health Organization guideline.
Results
The incidence of osteoporosis was highest in the AI with Ca/Vit D group (n=50, 36.0%) and lowest in the tamoxifen only group (n=4, 17.4%). Furthermore, it showed statistical difference between the three groups (p=0.003). However, considering the baseline of initial BMD in each patient, the mean change value did not show any statistical difference between the three groups (p=0.498). Moreover, the lumbar T-scores were lower than that of the total hip T-scores in each patient.
Conclusion
Although it has been reported that osteoporosis is common in patients treated with AI, the decreased BMD was not significantly severe compared to that in the tamoxifen alone group if Ca/Vit D was administrated with AI. Therefore, Ca/Vit D has some preventive effect for osteoporosis in patients treated with AI.
서 론
다양한 분자학적 특성 중 하나인 호르몬수용체양성 유방암은 여성호르몬인 에스트로겐과 프로게스테론이 유방암의 수용체에 부착함으로써 암세포의 증식이 진행되는 기전을 가진다[1,2]. 따라서 유방암 세포의 증식을 억제하기 위해서는 호르몬수용체를 차단하거나 혈중 여성호르몬 수치를 낮추어야 하는데, 타목시펜(tamoxifen)이나 아로마타제 억제제(aromatase inhibitor)가 가장 흔히 사용되는 호르몬치료제이다[3-5]. 특히 에스트로겐 수용체에 부착하여 에스트로겐이 암의 증식에 관여하지 못하게 하는 기전을 가진 타목시펜은 전 세계적으로 가장 많이 이용되는 호르몬 치료제로, 폐경 여부와 상관없이 비교적 좋은 치료효과를 보이는 것으로 알려져 있다[6,7]. 그러나 폐경 후 여성의 침윤성 유방암(invasive breast cancer)에서는 타목시펜보다 에스트로겐의 체내 합성에 필요한 효소인 아로마타제의 작용을 직접적으로 억제하는 아로마타제 억제제가 조금 더 유의한 치료효과를 보이는 것으로 보고되고 있다[8-12].
타목시펜은 부가적인 효과(adverse effect)로서 골밀도(bone mineral density)를 증가시키는 것으로 알려져 있지만, 부작용(side effect)으로는 자궁내막증, 혈전증, 고중성지방혈증 등을 일으키는 것으로 알려져 있다[13,14]. 반면, 아로마타제 억제제는 골밀도를 감소시켜 골감소증 또는 골다공증을 야기할 수 있고, 약 50%-60%의 환자들이 약물 복용 초기에 관절통증이나 뼈통증을 호소한다[15-20]. Love RR 등[21]은 140명의 유방암을 진단받은 폐경 후 여성들을 대상으로 타목시펜을 복용시켰을 때 요추에서의 골밀도가 유의하게 증가하였음을 보고하였고, Hadji P 등[9]도 타목시펜을 복용한 군에서 요추의 골밀도가 증가하고 procollagen type I N-propeptide와 같은 골형성 표지자와 C-telopeptide와 같은 골재흡수 표지자가 감소하는 결과를 보고한 바 있다. 반면 많은 연구들이 아로마타제 억제제를 복용한 유방암 환자군에서는 골밀도가 유의하게 감소하고 골형성표지자와 골재흡수표지자는 증가한다고 보고하고 있다[21]. 이러한 연구들을 바탕으로 아로마타제 억제제를 복용한 환자군에서 타목시펜을 복용한 환자군에서보다 골밀도가 유의하게 감소하고, 골형성표지자와 골재흡수표지자는 증가함을 알 수 있다[16,17,22,23].
저자들은 이러한 연구들을 기반으로 하여 아로마타제 억제제와 칼슘/비타민D 복합제(calcium/vitamin D supplements) 병용투여군에서 타목시펜 단독투여군과 비교하여 골밀도가 잘 유지되는지 비교, 분석함으로써 아로마타제 억제제와 칼슘/비타민D 복합제의 병용투여가 골밀도에 미치는 영향을 확인해보고자 하였다.
방 법
2011년부터 2015년까지 칠곡경북대학교병원에서 유방암으로 진단되어 수술을 받은 환자 1,547명 중 호르몬치료 시작 후 1년 간격으로 적어도 3회 이상의 골밀도검사 결과가 존재하는 환자를 선별하였고, 그들의 의무기록을 후향적으로 검토하여 데이터를 수집하였다. 본 연구는 칠곡경북대학교병원 기관생명윤리위원회 승인을 받고 시행하였다(IRB No.KNUCH 2021-04-023).
환자들 중 진단 당시 연령이 50세 미만이거나 폐경 전인 경우, 호르몬치료를 받지 않은 경우, 호르몬치료 용법에서 타목시펜과 칼슘/비타민D 복합제를 병용하였거나 칼슘/비타민D 복합제 없이 아로마타제 억제제만 투여한 경우를 제외하고 최종적으로 249예를 대상으로 연구를 진행하였다. 호르몬 치료제의 종류와 용법에 따라 타목시펜 단독투여군 (n=23), 아로마타제 억제제 및 칼슘/비타민D 복합제 병용투여군 (n=139), 연장요법(extended regimen)으로서 타목시펜 5년 단독 투여 후 5년을 연장하여 아로마타제 억제제 및 칼슘/비타민D 복합제를 병용투여한 군(연장병용투여군) (n=87) 등 3개의 군으로 분류하였고, 각각의 치료는 예정된 기간만큼 완결한 경우만 연구대상으로 포함하였다(Figure 1).
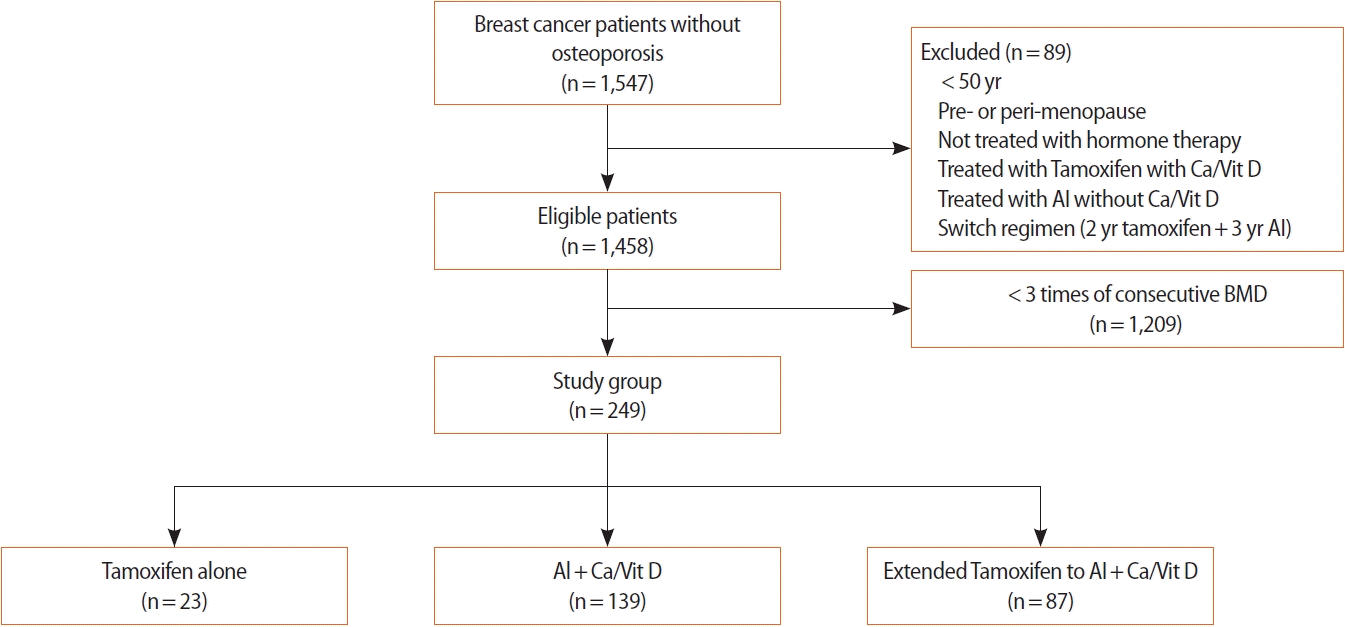
Selection diagram of patients with breast cancer who were received hormone treatment. BMD=bone mineral density; AI=aromatase inhibitor; Ca/Vit D=calcium and vitamin D supplementation.
환자들의 임상학적 인자에는 진단 당시 나이, 체질량지수(body mass index), 경구피임약 사용 여부, 폐경 여부, 종양의 크기, 수술 방법, 선행 또는 수술 후 항암화학요법과 방사선치료의 시행 여부, 호르몬치료 등을 포함하였고, 병리학적 인자로는 유방암의 종류, 병리학적 종양의 크기, 분자학적 특성 및 병기를 포함하였다. 또한 종양학적 결과는 추적관찰 기간 동안 발생한 유방암의 국소재발, 원격전이 및 사망 등을 분석하였다.
골다공증의 진단은 WHO 가이드라인에 따라 골밀도검사상 고관절(total hip)과 대퇴골 경부(femur neck) 중 낮은 T-score를 선택하였고, 요추 1-4 (lumbar spine 1-4)의 평균 T-score를 선택하여 채택된 두 값 중 더 낮은 값을 최종 선택하여 진단하였다[24]. 골밀도는 요추와 고관절 또는 대퇴골 경부 중 가장 낮은 T-score가 ≥-1일 경우 정상, >-2.5, <-1일 경우 골감소증, ≤-2.5일 경우 골다공증으로 분류하였다. 또한 환자의 호르몬치료 시작 당시 골밀도 상태에 따라 골밀도 변화량이 다를 수 있으므로 개인별 골밀도 변화를 확인하기 위하여 각 환자들의 첫 골밀도 상태를 기준으로 한 골밀도 변화량도 추가적으로 조사하였다.
통계학적 분석은 SPSS ver.25 (IBM Corp., Armonk, USA)를 이용하였고, p<0.05일 때 통계학적으로 유의하다 판단하였다. 호르몬치료 용법에 따른 3개 군의 골다골증 발생률을 범주형 변수로 간주하고 카이제곱 검정(Pearson’s Chi-square test)을 적용하였으며, 개인별 골밀도 변화를 확인하기 위해 호르몬치료 3개 군의 처음과 마지막 골밀도 결과값의 차이를 연속형 변수로 간주하고 분산분석(ANOVA)을 시행하여 통계학적 유의성을 확인하였다.
결 과
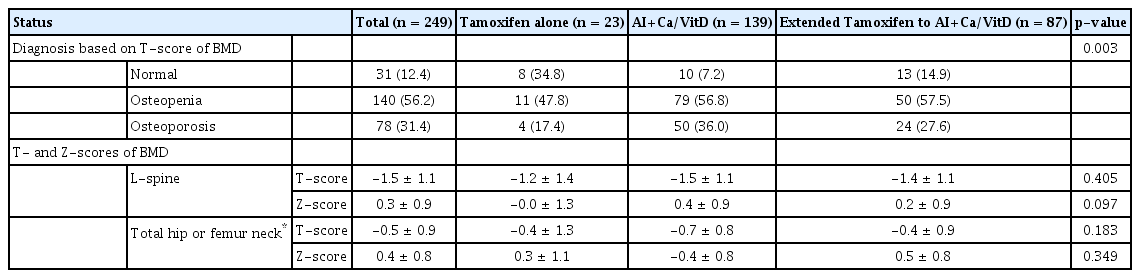
전체 환자들의 평균연령은 58.2세(표준편차, ±7.7)로, 세 군의 평균연령은 타목시펜 단독투여군에서 유의하게 가장 낮은 것으로 확인되었으나(p<0.001), 세 군 모두 50세 이상의 폐경 여성으로 구성되었으므로 임상적 의미는 없는 것으로 판단하였다. 환자들의 체질량지수나 유방암 또는 난소암의 가족력 역시 각 군에서 유의한 차이는 없었다. 또한 연장투여군에서 양측성 유방암의 빈도가 유의하게 높은 것으로 확인되었으나(p=0.008), 타목시펜 단독투여군에서 양측성 유방암 환자가 없어 통계학적 신뢰도가 높지 않다고 볼 수 있다. 액와부 수술방법은 감시림프절 생검술이 병용투여군에서 유의하게 많이 시행되었고(p=0.005), 선행항암화학요법의 시행률은 타목시펜 단독투여군에서 유의하게 높은 것으로 확인되었다(p=0.018) (Table 1).

Clinical characteristics of patients with breast cancer in postmenopausal woman who received hormone treatment after surgery for breast cancer
유방암의 종류는 모든 군에서 침윤성 유관암(invasive ductal carcinoma)이 가장 많았으며, 이 중 병용투여군(n=128, 92.0%)에서 가장 높은 빈도를 보였다(p=0.038). 그 외 종양의 병리학적 평균 크기 및 액와부 림프절 전이여부, 유방암의 병리학적 병기 등은 모두 세 군 간 유의미한 차이가 없었다(Table 2).
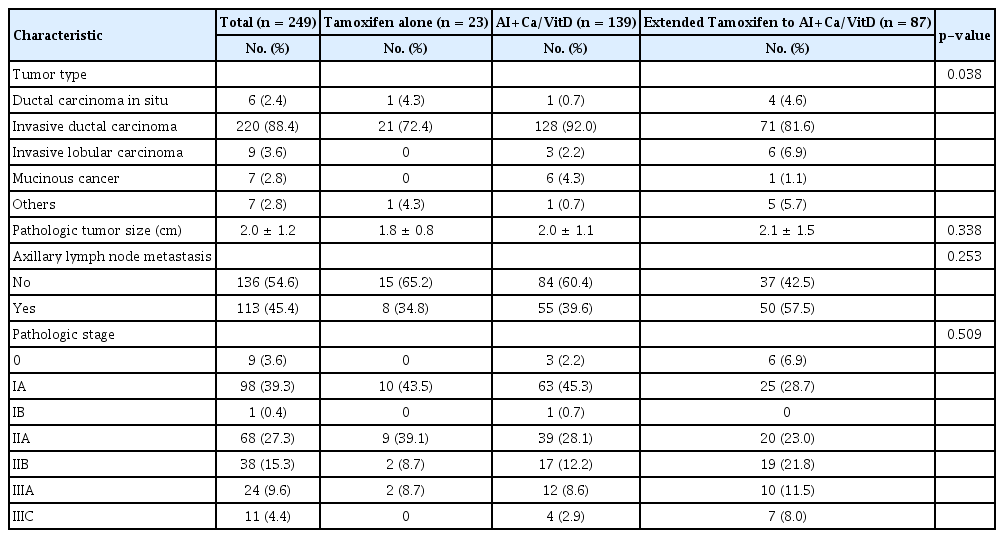
Pathologic characteristics of patients with breast cancer in postmenopausal woman who received hormone treatment after surgery for breast cancer
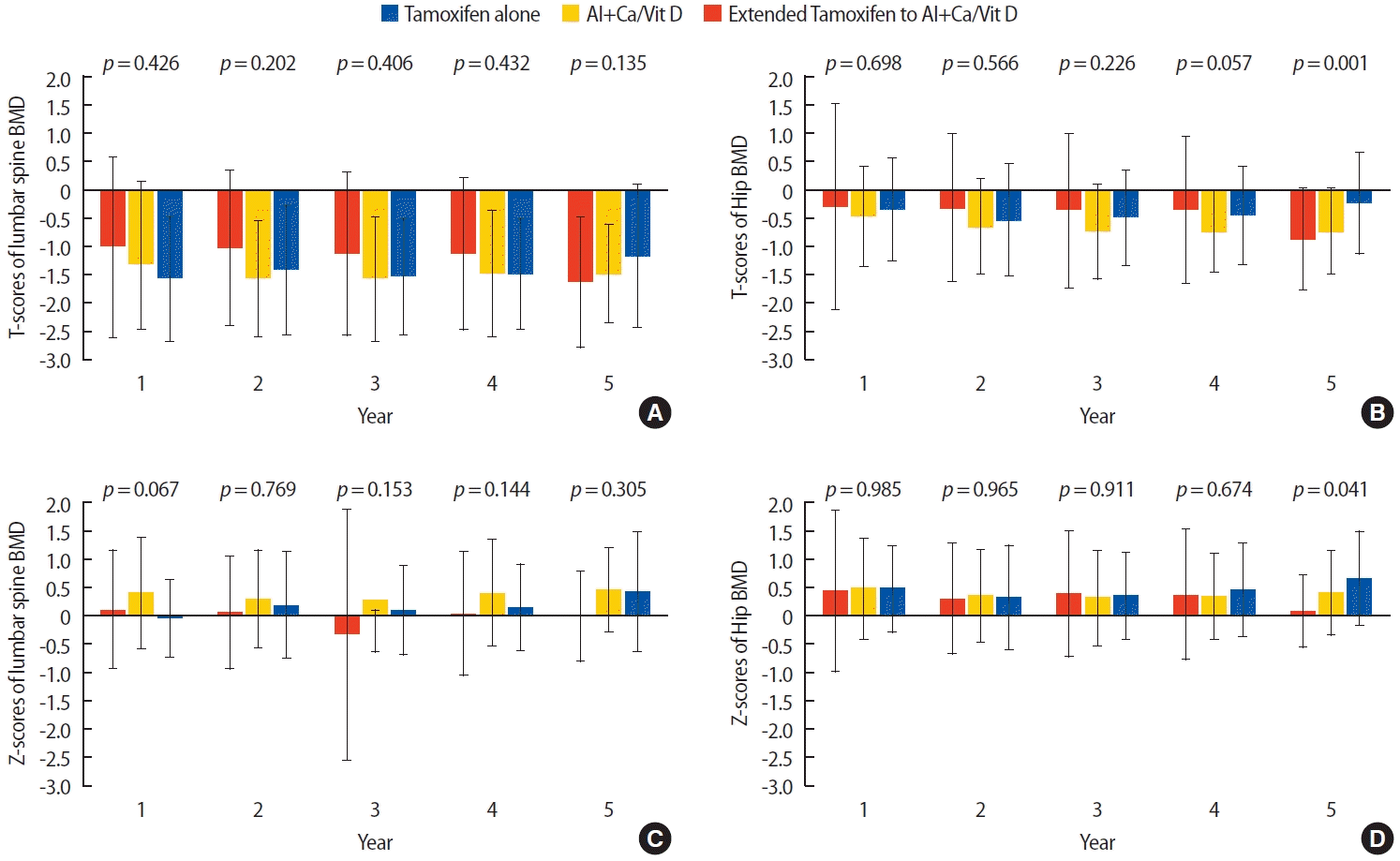
5년 동안 3회 이상 연속적으로 추적관찰한 골밀도검사에서 평균 T-score는 타목시펜 단독투여군에서 -1.2 (표준편차, ±1.4), 병용투여군은 -1.5 (표준편차, ±1.1), 연장병용투여군은 -1.4 (표준편차, ±1.1)로 병용투여군에서 가장 낮은 것으로 확인되었다(p=0.405). 골밀도의 T-score를 기반으로 한 진단에서 전체 환자 중 정상은 31명(12.4%), 골감소증은 140명(56.2%), 골다공증은 78명(31.4%)이었다. 요추와 고관절 또는 대퇴골 경부의 평균 T-score와 Z-score는 세 군간에서 통계학적으로 유의한 차이는 확인되지 않았지만, 모든 군에서 고관절에 비하여 요추의 평균 T-score가 낮은 것으로 확인되었다(Table 3). 골다공증의 빈도는 병용투여군(36.0%), 연장병용투여군(27.6%), 타목시펜 단독투여군(17.4%)의 순으로 높게 나타났다(p=0.003) (Figure 2).
Status of BMD in postmenopausal woman who received hormone treatment after surgery for breast cancer
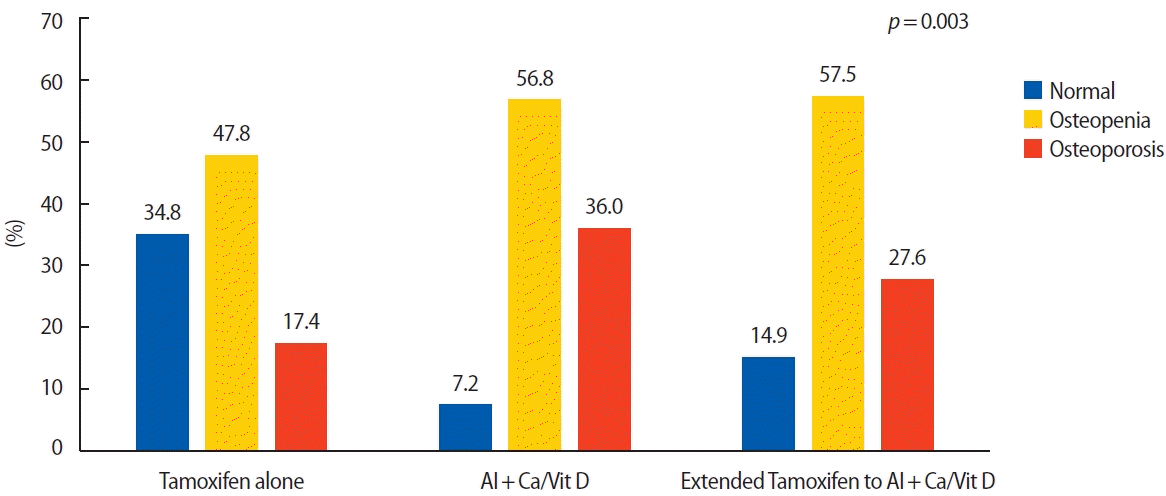
Diagnosis of osteopenia and osteoporosis based on T-score of BMD in postmenopausal woman who received hormone treatment after surgery for breast cancer. BMD=bone mineral density; AI=aromatase inhibitor; Ca/Vit D=calcium and vitamin D supplementation.
그러나, 평균 T-score는 개인의 처음(initial) T-score와는 상관없이 나타나는 절대값으로서 개인별 기저 골감소 정도를 반영하지 못하는 것으로 판단하여 각 연도별 개개인의 T-score의 변화를 첫 T-score를 기준으로 조사하였고, 평균 T-score의 결과와 동일하게 모든 군에서 요추의 T-score가 고관절의 T-score보다 낮은 것을 확인할 수 있었다. 개개인의 첫 T-score를 기준으로 변화값을 통계학적으로 분석해보았을 때 골밀도 변화량의 평균은 타목시펜 단독투여군이 -0.3 (표준편차, ±0.6), 병용투여군이 -0.3 (표준편차, ±0.6), 연장투여군이 -0.2 (표준편차, ±0.6)으로 세 군 간의 유의한 차이는 없었다(p=0.498) (Supplementary Figure 1). 5년째 고관절 골밀도의 T-score 변화는 통계학적으로 유의한 것으로 나타났지만(p=0.001), 요추의 평균 T-score와 비교하여 높게 나타나 골밀도 감소 정도의 진단에 미치는 영향은 없을 것으로 판단된다(Figure 3, Supplementary Table 1).
고 찰
호르몬수용체양성 유방암의 호르몬치료에 사용되는 약제는 주로 타목시펜이나 아로마타제 억제제이다[24]. 타목시펜은 골밀도를 대체적으로 증가시키는 것으로 알려져 있지만 자궁내막증, 혈전증, 고중성지방혈증 등의 발생빈도를 높이는 것으로 보고되고 있는 반면, 아로마타제 억제제는 비교적 많은 환자들이 관절통을 호소하며 골밀도를 감소시켜 골감소증 또는 골다공증을 야기하는 것으로 보고되고 있다[7-12,20]. 이를 보완하기 위하여 많은 의사들은 아로마타제 억제제와 칼슘제나 칼슘/비타민D 복합제를 병용투여시킨다[24, 25].
본 연구에서는 폐경 후 유방암환자에서 아로마타제 억제제와 칼슘/비타민D 복합제를 병용투여하는 경우 골밀도 감소가 없는 것으로 알려져 있는 타목시펜 단독투여군과 비교하여 골밀도 변화에 차이가 나는지, 아로마타제 억제제와 칼슘/비타민D 복합제만 투여하는 군과 타목시펜 투여 5년 후 아로마타제 억제제와 칼슘/비타민D 복합제를 5년 연장하여 투여하는 연장병용투여군 간에도 차이가 나는지 확인해 보고자 하였다. 연속적인 골밀도 검사의 평균 T-score는 아로마타제 억제제를 포함하는 병용투여군과 연장병용투여군 모두에서 타목시펜에 비하여 통계학적으로 유의하게 낮은 절대값을 보였지만, 이는 개개인의 첫 골밀도 상태를 반영하지 못하는 것으로 통계학적 신뢰도는 낮다고 볼 수 있다. 따라서 저자들은 개인별 골밀도 감소의 변화량이 더 중요한 임상적 가치가 있을 것으로 판단하여 조사하였고, 결과적으로 통계학적 유의성이 확인되지 않아 타목시펜 단독투여군과 병용투여군, 연장병용투여군에서 골밀도 변화에는 차이가 없는 것으로 판단된다.
본 연구에서 포함된 여러 임상인자들 중 병용투여군에서 환자들의 평균 나이가 높은 것으로 확인되었는데(p<0.001), 모든 환자가 50세 이상의 폐경여성으로 구성된 것을 감안할 때 큰 의의는 없는 것으로 판단된다. 또한 타목시펜 단독투여군에서 액와부 림프절 절제술의 빈도와 선행항암치료의 빈도가 높은 것은 병기가 높은 환자들이 많았음을 의미하는데, 아로마타제 억제제를 사용하지 않고 타목시펜을 사용한 이유는 다음과 같았다. 첫째, 아로마타제 억제제 복용 2주 이내 관절통이나 골통증이 심하여 복용이 불가했던 경우, 둘째, 처음에 폐경으로 확인되었지만, 이후 여성호르몬 수치가 다소 높아 폐경에 대한 확인이 조금 더 필요하였던 경우, 셋째, 연장병용투여요법을 계획하고 우선적으로 타목시펜만을 복용하고 있던 상태인 경우였다. 특히, 선행항암화학요법의 경우 타목시펜 단독투여군에서 유의하게 높은 빈도를 보이는 것으로 나타났지만, 선행항암화학요법이 골밀도 감소에 미치는 영향은 그리 크지 않아 본 연구에서 의의를 가지지는 못할 것으로 판단하였다.
저자들의 연구에서 확인되는 한계점은 다음과 같다. 첫째, 타목시펜 단독투여군이나 연장병용투여군의 환자수가 병용투여군에 비하여 적다. 특히, 타목시펜 단독투여군의 수가 월등히 적었던 점이 연구의 신뢰도에 다소 영향을 줄 수 있지만, 본 연구에서 확인하고자 하였던 아로마타제 억제제와 칼슘/비타민D 복합제 병용투여에 대한 효과를 판단하기에는 환자수가 충분하였다고 생각된다. 둘째, 환자들의 골건강에 영향을 줄 수 있는 나이, 체질량지수 및 환경적 요소 등 혼란변수(confounder)에 대해 보정하지 못했다는 점이다. 환자들의 나이나 기저질환, 신체구조 등에 차이가 있었을 것이고, 병원에서 처방한 약 이외에도 환자들이 각자 영양제나 추가적인 비타민을 복용하였을 가능성이 여전히 남아있다. 혼란효과를 통제하기 위해서는 연구 분석 단계에서 층화분석(stratification), 통계적 보정, 표준화(standardization) 과정이 필요하다. 또한 골다공증이 발생한 78명의 환자들은 골다공증 치료가 병행되었으므로 이후의 골밀도 평균 값에 대한 신뢰도는 다소 떨어질 수 있다. 정확한 연구를 위해서는 모든 요소들이 통제되었어야 하지만, 후향적 코호트 연구의 한계점이 있었다. 마지막으로 환자군에서 사용한 아로마타제 억제제의 종류가 anastrozole, letrozole, exemestane 등으로 다양했기 때문에 본 연구의 결과를 일반화시키기 위해서는 향후 각 종류에 따른 추가적 분석이 필요할 것으로 생각된다.
결론적으로 저자들의 연구에서 아로마타제 억제제와 칼슘/비타민D 복합제를 병용투여한 경우 단독병용요법이건 연장병용요법이건 타목시펜 단독투여군에 비하여 통계학적으로 유의한 골밀도 감소를 보이지는 않은 것을 확인할 수 있었고, 이는 아로마타제 억제제와 칼슘/비타민D 복합제의 병용투여가 골밀도 감소에 예방효과가 있음을 의미한다. 좀더 명확한 결론을 내리기 위해서는 더 많은 환자수로 혼란변수 등을 충분히 보정한 추가적인 연구가 필요하지만, 아로마타제 억제제를 투여해야 하는 경우 칼슘/비타민D 복합제를 병용투여시키는 것이 골밀도 보존에 도움이 될 것이다.
Notes
The authors declare that they have no competing interests.
Acknowledgements
The authors sincerely appreciate professor Tae In Park, dean of the School of Medicine, Kyungpook National University, and professor Eon Jeong Nam, student clinical research instructor of the School of Medicine, Kyungpook National University for allowing us and supporting this study.
Supplementary Material
Supplementary Table 1.
Changed value of personal T-scores compared to first T-score of BMD in postmenopausal woman who received hormone treatment
Supplementary Figure 1.
T-score differences of BMD in postmenopausal woman who received hormone treatment after surgery for breast cancer. BMD=bone mineral density.