AbstractPurposeLarger tumor size and more extensive lymph node (LN) involvement have been considered independent factors for poor prognosis of breast cancer. We evaluated whether smaller tumor size may be a factor of worse prognosis compared with larger tumor size in small-sized breast cancer with LN involvement.
MethodsA retrospective analysis was conducted at a single center for 1,400 patients with small-sized (≤2 cm) and LN involved (N1−N3) breast cancer who underwent radical surgery, had no distant metastases, and were diagnosed between 2004 and 2014. We subdivided their tumor size into four subgroups (T1mi, T1a, T1b, T1c) graded using the 7th American Joint Committee on Cancer staging and two subgroups (T1ab [≤1 cm] and T1c [>1 cm]) divided by tumor size. The relationship between tumor size, prognosis and specific features were analyzed using the Chi-square test, Kaplan-Meier method, and Cox regression analysis.
ResultsThere were significant differences in estrogen receptor, progesterone receptor, human epidermal growth factor receptor 2 (HER2) and HER2 amplified type among the four subgroups in all patients. Especially, HER2-amplified type also appeared in distribution significantly between the two subgroups in all patients (T1ab [13.0%] vs. T1c [8.0%], p=0.008). The overall survival of the T1N1 staged patients in the smaller-sized tumor group (T1ab) was lower than that of those in the larger-sized group (T1c) (p=0.005). In the multivariate Cox regression analysis of all patients, the T1ab group showed a higher mortality risk compared with the T1c group (adjusted hazard ratio, 2.540; 95% confidence interval, 1.195–5.397; p=0.015).
서 론유방암의 진단법이 증가하고 치료방법이 다양해짐에 따라 적절한 치료를 위한 유방암 특성 평가는 점점 중요해지고 있다. 이에 다양한 예후 인자들인 종양 크기, 림프절 전이 정도, 나이, 호르몬 수용체, 조직 병리, 림프관-혈관 침습 등에 대해 많은 확인이 이루어져 왔다[1-3]. 그들 중 특히 종양 크기와 림프절 전이 정도는 가장 중요한 예후 인자이며 American Joint Committee on Cancer (AJCC) staging system의 근본을 이룬다[4,5].
종양 크기의 증가는 겨드랑이 림프절 전이 위험 증가와 깊은 연관성을 나타낸다[5,6]. 이와 같이 종양 크기가 커질수록 림프절 전이 가능성이 높아짐에도 불구하고 오히려 작은 크기의 유방암에서 동반된 림프절 전이는 생물학적으로 좀 더 공격적인 표현형일 가능성이 높으며 역설적으로 원격 전이 위험성 증가나 나쁜 예후와 높은 연관성을 나타낼 수 있다[7-9].
유방암에서 전이 가능성과 그 시점을 파악하는 것은 중요한 일이다. 전통적으로 원격 전이는 종양 진행에 따라 늦은 시점에 발생한다고 알려져 왔으나 최근 연구에서는 몇몇 종양에서 종양 초기에 전이 가능성이 있다고 밝혀졌다. 이는 마찬가지로 림프절 전이가 있는 매우 작은 크기의 유방암에서 조기 전이 가능성을 시사한다[10].
따라서 림프절 전이가 있는 환자에서 종양 크기와 예후와의 관계에 대한 연구는 흥미로운 분야다. 이에 예후를 예측하는 데 있어 종양 크기와 림프절 전이의 관련성에 대해 조사를 시행했다. 또한 작은 크기의 유방암에서 종양 크기가 작을수록 예후가 나빠지는 지에 대해 조사하였다. 직접적인 예후를 나타내는 생존 기간과 간접적으로 관련성을 나타내는 여러 예후 인자들에 대해서 함께 조사를 하였다[6,11-13]. 작은 유방암 환자에서 림프절 전이와 예후와의 연관성에 대해서도 조사하였다. 더 나아가 림프절 전이가 있는 매우 작은 크기의 유방암에서 작은 종양의 크기가 예후에 영향을 미치는 지표가 될 수 있는지에 대해 알아보았다[7,14].
방 법환자 선택본 연구는 후향적 연구로서, 2004년부터 2014년까지 유방암으로 진단받은 환자 중 병리학적으로 종양 크기 2 cm 이하(T1, 7th AJCC staging), 림프절 침범(N1–N3, 7th AJCC staging)을 한 1,400명의 여성 환자를 대상으로 하였다. 모든 환자는 수술 전 항암치료를 받지 않았고, 유방 보존 절제술이나 유방 전 절제술과 함께 겨드랑이 림프절 절제술을 시행 받았다. 이 연구는 기관 생명 윤리 위원회(institutional review board, IRB) 승인을 받았다(IRB No. 2016-03-053).
결과 측정전체 환자를 종양 크기와 림프절 전이 정도에 따라 세부 그룹으로 나누어 각각의 세부 그룹 별 전체 생존 기간과 예후 관련 인자와의 연관성을 조사하고 종양 크기가 생존율에 미치는 영향을 조사하였다. 7th AJCC 에 기재되어 있는 분류체계를 따라서 종양 크기는 T1mi (0.1 cm 이하), T1a (0.1 cm 초과 0.5 cm 이하), T1b (0.5 cm 초과 1.0 cm 이하), T1c (1.0 cm 초과 2.0 cm 이하)로 나누었다. 추가적으로 종양 크기를 1 cm 기준으로 1 cm 이하 그룹(T1mi, T1a, T1b)과 1 cm 초과 그룹(T1c)으로 나누어 조사하였다(이하 종양 크기 1 cm 이하 그룹: T1ab, 종양 크기 1 cm 초과 그룹: T1c 로 갈음한다). 림프절 전이 단계는 7th AJCC 분류에 따라 N1 (1-3), N2 (4-9), N3 (10 이상)으로 나누었다.
연구 방법종양 크기와 예후와의 관련성을 조사하기 위해 예후와 관련된 여러 변수들을 조사하였다. 나이, 폐경, 가족력, 항암 치료, 방사선 치료, 호르몬 치료, 호르몬 수용체인 에스트로겐 수용체(estrogen receptor, ER), 프로게스테론 수용체(progesteron receptor, PR), 인간 표피세포 성장인자 수용체(human epidermal growth factor receptor 2, HER2), 내강형 A (Luminal A), 내강형 B (Luminal B), 인간 표피세포 성장인자 수용체 증폭형(HER2 amplified type, HER2 type) 및 삼중음성형(triple negative breast cancer, TNBC), 조직 병리 유형(histopathology), 림프절 전이 단계(N stage), 핵 분화도(nuclear grade), 림프관-혈관 침습(lympho-vascular invasion), 재발, 사망 등에 대해 조사를 하였다[15,16].
가족력은 2촌 이내의 직계 가족으로 정의했으며, 각종 호르몬 수용체의 경우 채취한 유방 조직을 면역 조직 화학 염색(immunohistochemistry)으로 검사하였다. 이 중 인간 표피세포 성장인자 수용체의 경우 면역 조직 화학 염색법의 결과를 양성(3+), 음성(0, 1+)으로 나누고 (2+) 결과의 경우 은제자리 부합법(silver-enhanced in situ hybridization, SISH)으로 유전자 증폭 여부를 확인해 양성과 음성 결과를 구분했다. 내강형 A는 에스트로겐 수용체 양성 또는 프로게스테론 수용체 양성이면서 인간 표피세포 성장인자 수용체 음성으로, 내강형 B는 에스트로겐 수용체 양성 또는 프로게스테론 수용체 양성이면서 인간 표피세포 성장인자 수용체 양성으로 정의하였으며, 인간 표피세포 성장인자 수용체 증폭형은 에스트로겐 수용체 음성, 프로게스테론 수용체 음성, 인간 표피세포 성장인자 수용체 양성으로, 삼중음성형은 에스트로겐 수용체 음성, 프로게스테론 수용체 음성, 인간 표피세포 성장인자 수용체 음성을 만족하는 상태로 정의했다. 재발은 추적 관찰 중 영상학적 검사를 통해 진단 하였고, 추적 관찰 기간은 수술 시점에서 가장 마지막 추적 관찰 시점까지의 기간으로 정의했다. 전체 생존기간(overall survival)은 사망의 원인과 관계없이 연구 시점에서 생존 유무를 통해 조사하였다.
본 연구는 종양 크기에 따른 생존율을 조사하였고, 림프절 전이 정도 차이에 따른 예후 영향을 최소화하기 위해 림프절 전이 단계가 같은 환자끼리 묶어 T1N1, T1N2, T1N3으로 나누었다. 이렇게 나눈 세 군 각각에 대해 종양 크기와 예후와의 관련성도 조사하였다.
통계 모델종양 크기와 예후 인자와의 관련성은 일원분산분석(one-way analysis of variance)과 chi-square test를 통해 이루어졌다. 전반적인 종양 크기와 예후와의 관련성은 log-rank statistics를 이용한 Kaplan-Meier analysis를 통해 이루어졌다. Adjusted hazard ratios는 Cox proportional hazards를 통해 계산하였다. Cox 다변수 회귀 분석에서 내강형 A, 내강형 B, 인간 표피세포 성장인자 수용체 증폭형과 삼중 음성형 변수는 에스트로겐 수용체, 프로게스테론 수용체, 인간 표피세포 성장인자 수용체 변수에서 파생된 변수로 다중 공선성에 문제가 될 수 있어 인간 표피세포 성장인자 수용체 증폭형과 삼중 음성형 변수는 제외하고 에스트로겐 수용체, 프로게스테론 수용체, 인간 표피세포 성장인자 수용체 변수를 포함한 분석을 시행하였다. 탐색적 조사가 이루어졌으며 p-value 0.05 미만을 유의한 값으로 정의하였다. 모든 통계적 분석은 SAS version 9.4 (SAS Institute, Cary, USA)을 통해 시행했다.
결 과기술 통계이 연구에 적합한 조건을 만족하는 1,400명의 여성 환자들을 조사하였다. 환자들의 나이는 평균 49.1세(± 9.9세)였고, 23세부터 88세까지 분포하였으며, 평균 추적 관찰 기간은 62개월이었다. 세부 그룹의 환자 수는 각각 T1mi=17, T1a=63, T1b=220, T1c=1,100, T1ab=300이다. 전체 환자 중 39명(2.8%)의 환자가 유방암으로 사망하였다. 세부 그룹의 사망 환자 수는 다음과 같다: T1mi=1 (5.9%), T1a=2 (3.2%), T1b=10 (4.5%), T1c=26 (2.4%), T1ab=13 (4.3%).
예후 관련 인자TNM stage 기준종양 크기를 7th AJCC staging system에 의거하여 T1mi, T1a, T1b, T1c의 세부그룹으로 나누었을 때, 에스트로겐 수용체, 프로게스테론 수용체, 인간 표피세포 성장인자 수용체, 인간 표피세포 성장인자 수용체 증폭형, 림프절 전이 단계, 핵 분화도, 림프관-혈관 침습 항목에서 그룹 간 유의한 차이를 보였다. 에스트로겐 수용체의 경우 T1mi 그룹(52.9%)은 T1b 그룹(15.5%)과 T1c 그룹(20.4%)보다 음성 결과가 높은 비율로 나타났고(p=0.002, p=0.010), T1a 그룹 (33.3%)은 T1b 그룹보다 음성 결과가 높은 비율로 나타났다 (p=0.011). 프로게스테론 수용체의 경우 T1mi 그룹(58.8%)은 T1b 그룹(18.6%)과 T1c 그룹(26.4%)보다 음성 결과가 높은 비율로 나타났고(p=0.002, p=0.017), T1a 그룹(34.9%)은 T1b 그룹보다 음성 결과가 높은 비율로 나타났으며(p=0.029), T1b 그룹은 T1c 그룹보다 음성 결과가 낮은 비율로 나타났다(p=0.047).
인간 표피세포 성장인자 수용체에서는 T1a 그룹(41.3%)이 T1b 그룹(18.6%)과 T1c 그룹(19.3%)보다 양성 결과가 높은 비율로 나타났다(p=0.001, p<0.001). 인간 표피세포 성장인자 수용체 증폭형은 T1mi 그룹(35.3%)에서 T1b 그룹(8.2%)과 T1c 그룹(8.0%)보다 높은 비율로 나타났고(p=0.012, p=0.005), T1a 그룹(23.8%)에서 T1b 그룹과 T1c 그룹보다 높은 비율로 나타났다(p=0.004, p<0.001).
림프절 전이 단계의 경우 N1 군에 비해 N2 군의 비율이 T1b 그룹 (7.4%)보다 T1c 그룹(13.4%)에서 더 높게 나타났고(p=0.032), N1 군에 비해 N3 군의 비율이 T1b 그룹(1.5%)보다 T1c 그룹(5.9%)에서 더 높게 나타났다(p=0.012).
림프관-혈관 침습은 T1a 그룹(26.7%)에서 T1c 그룹(49.9%)보다, T1b 그룹(38.2%)에서 T1c 그룹보다 낮은 비율로 나타났다(p=0.002, p=0.007).
종양 크기 1 cm 기준종양 크기 1 cm 기준으로 나눈 두 그룹 간 인간 표피세포 성장인자 수용체, 인간 표피세포 성장인자 수용체 증폭형, 림프절 전이 단계, 핵 분화도, 림프관-혈관 침습, 재발 항목의 분포가 유의한 차이를 보였다(Table 1). 인간 표피세포 성장인자 수용체의 경우 T1c 그룹(19.3%)에 비해 T1ab 그룹(24.7%)에서 양성 결과가 높은 비율로 나타났다(p=0.041). 인간 표피세포 성장인자 수용체 증폭형의 경우 T1ab 그룹(13.0%)에서 T1c 그룹(8.0%)에 비해 높은 비율로 나타났다(p=0.008). 삼중 음성형은 T1ab그룹(6.7%)보다 T1c 그룹(11.3%)에서 높은 비율로 나타났다(p=0.019).
림프절 전이 단계의 경우, T1ab 그룹과 T1c 그룹 간 N1, N2, N3 각 군의 비율이 유의하게 달랐다(p=0.007). 특히, N1 군과 N3 군 간에 비율 분포가 유의하게 다르게 나타났는데(p=0.026), N1 군의 비율은 T1ab 그룹이 89.3%로 T1c 그룹의 82.1%에 비해 높은 반면, N3 군의 비율은 T1ab 그룹이 2.0%로 T1c 그룹 5.2% 보다 낮았다.
핵 분화도의 경우 T1ab 그룹과 T1c 그룹 간 저등급, 중등급, 고등급 각 그룹의 비율이 유의하게 달랐다(p<0.001). 그 중에서 저등급 그룹과 중등급 그룹 간, 저등급 그룹과 고등급 그룹 간의 비율 분포가 유의하게 다르게 나타났는데(p=0.001, p<0.001), 저등급 그룹의 비율은 T1ab 그룹이 22.9%로 T1c 그룹의 12.8%에 비해 높은 반면, 중등급 그룹의 비율은 T1ab 그룹이 49.7%로 T1c 그룹의 52.8% 보다 낮았고, 고등급 그룹의 비율은 T1ab 그룹이 27.4%로 T1c 그룹의 34.4% 보다 낮았다.
림프관-혈관 침습은 T1ab 그룹(36.5%)에 비해 T1c 그룹(49.9%)에서 더 높은 비율로 나타났다(p<0.001). 재발은 T1ab 그룹(4.7%)보다 T1c 그룹(8.1%)에서 더 높은 비율로 나타났다(p=0.044).
T1ab 그룹에서 사망 환자
Table 2는 T1ab 그룹에서 사망한 13명의 다양한 임상 정보를 나타낸다. 림프절 전이 단계는 N1이 10명, N3가 3명이었다. 핵 분화도 결과는 고등급이 13명 중 8명이고, 림프관-혈관 침습은 13명 중 6명, 재발의 경우 원격재발이 13명 중 9명이었다.
종양 크기 따른 전체 생존 기간종양 크기 1 cm 기준으로 환자를 나누었을 때, 전체 환자에서 5년 생존율은 T1ab 그룹에서 93.6%, T1c 그룹에서 94.3%로 T1ab 그룹에서 생존율이 더 낮고, 생존기간이 더 감소하는 경향을 보였으나 유의한 차이를 나타내지는 않았다(p=0.068) (Figure 2). 림프절 전이 단계별로 환자를 구분하여 조사한 결과는, T1N1 환자 군에서 종양 크기가 작은 그룹일수록 종양 크기가 큰 그룹에 비해 전체 생존기간이 유의하게 감소하는 경향을 보였으며 5년 생존율은 T1ab 그룹에서 94.1%, T1c 그룹에서 98.1%로 T1ab 그룹에서 생존율이 더 낮았다(p=0.005) (Figure 3).
Cox 비례 위험 모형단 변수 분석에서는 나이, 폐경, 항암 치료, 호르몬 치료, 에스트로겐 수용체, 프로게스테론 수용체, 삼중 음성형, 림프절 전이 단계, 핵 분화도 변수가 사망 발생에 유의한 영향을 끼치는 것으로 나타났다. 65세 이상 그룹이 65세 미만 그룹에 비해서 사망 발생 위험률이 3.510배 크게 나타났다(p=0.003). 또한 폐경한 환자가 사망 발생 위험율 2.916배 크게 나타났다(p=0.001). 항암 치료와 호르몬 치료의 경우 치료를 받은 그룹에서 사망 발생 위험률이 각각 0.358배와 0.485배로 감소했다(p=0.033, p=0.002). 에스트로겐 수용체와 프로게스테론 수용체는 음성인 그룹이 사망 발생 위험률 각각 2.672 배, 2.966배로 더 높게 나타났다(p=0.002, p<0.001). 삼중 음성형 항목에서는 양성인 그룹이 사망 발생 위험률 2.219배로 더 높게 나타났다(p=0.036). 림프절 전이 단계의 경우 N3군이 N1군보다 사망 발생 위험률이 12.12 배 더 높게 나타났다(p<0.001). 핵 분화도의 경우 전체 그룹 간의 유의한 사망 발생 위험률 차이는 보였으나(p=0.040), 세부 그룹 간의 비교에서 유의한 차이를 보이지는 못했다.
다변수 분석 결과 다른 변수들이 일정할 때, 림프절 침범을 한 종양 크기 2 cm 이하의 전체 유방암 환자에서 종양 크기 1 cm 기준으로 나눈 두 그룹 간의 사망에 대한 위험률이 다름을 확인할 수 있었고, T1ab 그룹이 T1c 그룹보다 사망 발생 위험률이 2.540배더 크게 나타났다(p=0.015). 항암 치료를 시행했을 때 사망 발생 위험률이 0.118배로 감소했고(p=0.002), 림프절 전이 단계 항목에서 N1군에 비해 N3군에서 사망 발생 위험률이 16.423배로 유의하게 증가했다(p<0.001) (Table 3).
T1N1 환자 군에서 시행한 다변수 분석 결과는 T1ab 그룹이 T1c 그룹보다 사망 발생 위험률이 3.324 배 더 크게 나타났다(p=0.008).
또한 유의한 사망 위험도를 나타낸 종양 크기와 림프절 전이 단계 항목만을 변수로 취하여 시행한 전체 유방암 환자에서의 다변수 분석 결과는 T1ab 그룹이 T1c 그룹보다 사망 발생 위험률이 2.318배 더 크게 나타났다(p=0.016).
고 찰이번 연구에서 림프절 침범이 있는 크기가 작은 유방암 환자에서 종양 크기와 예후와의 연관성에 대해 조사하였다. 이전의 Wo 등[7]연구에서는 작은 크기의 유방암에서 림프절 침범이 있는 경우 종양 크기가 작을수록 예후가 나쁠 수 있는지 조사하였고, Kasumi [17] 연구에서는 크기가 작은 유방암 환자에서 림프절 침범이 있는 경우 예후가 실제 암 병기에서 기대되는 것과 달라질 수 있으며 임상적 상태에 따라 새롭게 정의되어야 한다고 언급했다. 우리 연구에서도 림프절 침범이 있는 작은 유방암에서의 예후에 초점을 두었으며, 2 cm 이하의 작은 크기의 유방암 환자로 크기를 제한하고 종양 크기를 다양한 방법으로 단계 지어 나눈 뒤 그에 따라 다양한 인자와의 관련성을 조사하였다. 또한 같은 림프절 전이 단계끼리 묶어서 동일한 림프절 전이 단계 환자 군내에서의 종양 크기와 예후와의 관련성에 대해서도 조사하였다.
7th AJCC staging system과 종양 크기 1 cm 기준에 따라 종양 크기를 하위 세부 그룹으로 나누고 이에 대해 다양한 인자들의 분포를 조사하였다. 그 중에서도 에스트로겐 수용체, 프로게스테론 수용체 항목은 7th AJCC staging system에 따른 분류에서, 인간 표피세포 성장인자 수용체, 인간 표피세포 성장인자 수용체 증폭형, 림프절 전이 단계, 핵 분화도, 림프관-혈관 침습 항목은 7th AJCC staging system과 종양 크기 1 cm 기준에 따른 두 분류 모두에서 유의한 그룹 간의 분포 차이가 나타났다[10-12,18]. 에스트로겐 수용체나 프로게스테론 수용체는 음성일수록 나쁜 예후를 시사한다고 알려져 있고[19-21], 이번 연구에서도 종양 크기가 작은 그룹일수록 크기가 큰 그룹보다 음성 결과가 대체로 높은 비율로 나타나 종양 크기가 작을수록 나쁜 예후를 시사한다는 가설을 뒷받침해준다[22,23].
인간 표피세포 성장인자 수용체 항목에서도 종양 크기가 작은 그룹일수록 예후가 나쁘다고 알려져 있는 양성 결과가 높은 비율로 나타났다. 기존의 Bulut와 Altundag [21] 연구와 Kim 등[24] 연구에서는 조기 유방암에서 인간 표피세포 성장인자 수용체 증폭형이 나쁜 예후와 유의한 연관성이 있다고 밝힌 바 있다. 이번 연구에서 예후가 나쁘다고 알려진 인간 표피세포 성장인자 수용체 증폭형이 종양 크기가 작은 그룹에서 큰 그룹보다 유의하게 높은 비율로 분포하여 우리 연구의 주제와 부합함을 확인했다.
림프절 전이 단계 분포를 보면 림프절 침습의 비율이 종양 크기가 큰 그룹에서 더 높게 나타났는데 종양 크기가 클수록 림프절 침습이 더 높게 나타난다고 할 수 있다[5,12,15]. 특히 핵 분화도에서는 7th AJCC 기준에서는 종양 크기에 따른 분포의 경향성이 나타나지 않았고, 종양 크기 1 cm 기준에서는 저등급 그룹에 비해 중등급 그룹과 고등급 그룹의 비율이 T1ab 그룹에서 적은 분포로 나타나 종양 크기가 작을수록 나쁜 예후와 깊은 연관성을 보이지 못했다. 이는 세부 그룹의 수가 적고 핵 분화도 분포 역시 편중되어 있어 의미 있는 결론이 도출되기 어려웠던 것으로 판단된다.
반면 림프관-혈관 침습에서는 나쁜 예후와 연관성 깊은 침습 분포가 종양 크기가 큰 그룹일수록 높은 비율로 나타났다[25]. 림프관-혈관 침습은 종양 크기가 클수록 나쁜 예후를 시사하는 결과가 높은 비율로 나타났는데, 이러한 결과에도 불구하고 종양 크기가 작은 세부그룹에서 생존율 등 예후가 안 좋게 나타난 것은 크기가 작은 종양에서 나타나는 생물학적 특성이 림프관-혈관 침습보다 환자의 예후에 더 큰 영향을 미친다고 볼 수 있다.
T1ab 그룹에서 사망한 13명의 환자들을 살펴보면 종양 크기가 작음에도 불구하고 림프절 전이 단계가 높은 환자가 있었고, 림프관-혈관 침습도 절반 가량 나타났다. 또한 핵 분화도가 대부분 높고, 원격 재발을 한 경우가 많아 나쁜 예후와 관련된 인자들이 작은 종양 크기 그룹에서 많은 연관성을 나타냄을 확인할 수 있었다.
전체 환자에서 림프절 전이 단계에 따른 생존 함수 분석에서 림프절 전이 단계가 높을수록 전체 생존기간이 유의하게 감소함을 확인했고, 이는 림프절 전이 단계가 높을수록 생존율이 감소하는 기존 사실과 부합한다[5]. 종양 크기와 생존기간과의 연관성 조사에서는 1 cm 기준으로 종양 크기를 나누었을 때, T1ab 그룹에서 T1c 그룹에 비해 5년 생존율이 더 낮고, 전체 생존기간이 비교적 명시적으로 감소하는 경향을 나타냈다. 앞서 언급했던 대로, 림프절 전이로 인한 예후 영향을 최소화 하기 위해 T1N1, T1N2, T1N3 세 군으로 나누어 생존기간을 조사하였고, 그 결과 특히 T1N1 환자 군에서는 T1ab 그룹에서 T1c 그룹에 비해 유의하게 5년 생존율이 더 낮고, 전체 생존기간이 감소했다. 이는 작은 크기의 유방암 환자에서 종양 크기가 작을수록 예후가 나쁠 수 있음을 시사한다.
Cox 회귀 분석을 통한 단 변수 분석에서는 나이, 폐경, 에스트로겐 수용체, 프로게스테론 수용체, 삼중 음성형, 림프절 전이 단계, 핵 분화도 변수가 사망 위험과 유의한 연관성을 나타냈다. 고령에서 사망 발생 위험이 더 크다는 것을 확인할 수 있었고, 폐경 환자 그룹에서 사망 발생 위험이 큰 것을 확인했다. 항암 치료와 호르몬 치료를 받은 경우 사망 발생 위험도가 감소하는 것은 수술 후 추가적 치료가 유효함을 확인할 수 있는 결과였다. 에스트로겐 수용체와 프로게스테론 수용체는 기존에 알려진 대로 음성 그룹에서 사망 발생 위험이 큰 것으로 나타났고, 삼중 음성형 그룹에서도 기존의 연구 결과들처럼 사망 발생 위험도가 증가하였다[23]. 림프절 전이 단계는 N3군처럼 림프절 전이 정도가 심할수록 사망 발생 위험률이 증가함을 확인할 수 있었고[4,5], 핵 분화도의 경우 세부 단계 간의 비교 조사에서는 사망 발생 위험률의 유의한 차이를 발견하지 못했으나, 전체 세 그룹 간의 유의한 위험도 차이가 있고, 등급이 증가할수록 사망 발생 위험률이 증가하는 경향을 보여, 등급이 높을수록 나쁜 예후에 영향을 끼치는 핵 분화도의 특성을 다시 확인할 수 있었다. 암의 조직학적 분류에 따른 사망 발생 위험에 대한 비교 조사는 사망 발생이 없는 세부 그룹이 포함되어 있어 비교 연구가 불가하였다.
Cox 회귀 분석을 통한 다 변수 분석에서는 유의한 값을 도출할 수 있었다. 기존에 다른 변수들의 영향이 조정되지 않은 채 시행된 전체 환자 군의 생존 함수에서는 T1ab 그룹이 T1c 그룹에 비해 생존 확률이 낮아지는 경향은 보였지만 유의한 결과를 나타내진 못했고(p=0.068), 사망 발생 위험률 역시 유의한 차이를 나타내지 못했다(p=0.073). 반면 다른 변수들이 일정하게 조정된 Cox 다변수 분석에서는 전체 환자 군에서 T1ab 그룹이 T1c 그룹에 비해 사망 발생 위험률이 2.540배 증가함을 확인할 수 있었다(p=0.015). 이번 연구에서 우리는 예후 관련 인자 분석 및 Cox 단 변수 분석을 통해 나쁜 예후를 보이는 림프절 전이 단계의 N3군과 핵 분화도의 고등급 그룹이 T1ab 그룹보다 T1c 그룹에서 높은 비율로 나타남을 알 수 있었다. 다변수 분석에서 이 같은 예후 관련 인자들이 보정되면서 T1ab 그룹의 높은 사망 발생 위험이 유의한 값으로 도출된 것으로 판단된다. 이는 우리가 핵심 연구 주제로 설립했던 작은 크기의 유방암 환자에서 종양 크기가 작을수록 예후가 나쁘다는 가설을 명확히 뒷받침해주는 결과라 할 수 있다.
이 외에 항암 치료와 림프절 전이 단계 변수에 대한 Cox 다변수 분석에서도 통계적으로 유의한 값을 얻을 수 있었다. 항암 치료를 시행 받은 환자의 사망 발생 위험률이 0.118배로 감소하여 항암 치료가 수술 후 환자 치료에 사망 위험을 감소시키고 예후를 좋게 함을 확인할 수 있었고, 림프절 전이 단계의 경우 N1군보다 N3군의 사망 발생 위험률이 16.423배로 높아 기존에 알려진 대로 림프절 침습이 심할수록 환자 사망 위험이 높아지고 예후가 나빠진다는 것을 확인할 수 있었다[5].
위 결과를 보면 T1ab 그룹보다 N3군이 상대적으로 높은 위험도를 보이며 더 강력한 사망 위험 인자라고 할 수 있다. 이 같은 림프절 전이 단계에 따른 예후 차이를 배제하기 위해 T1N1 환자 군에 한정해 시행한 다변수 분석 결과에서는 T1c 그룹에 대한 T1ab 그룹의 사망 위험도가 이전 값보다 증가한 결과를 나타냈고, 이를 통해 좀 더 확연히 작은 종양 크기의 사망 위험 증가에 대한 영향을 확인할 수 있었다. 또한 종양 크기와 림프절 전이 단계 항목만을 변수로 시행한 다변수 분석 결과에서 역시 T1c 그룹에 대한 T1ab 그룹의 사망 위험도가 유의한 값으로 나타나 작은 종양 크기가 예후 인자로서 유의함을 확인할 수 있었다.
이처럼 Wo 등[7] 연구나 Houvenaeghel 등[9] 연구에서와 동일하게 작은 유방암에서 종양 크기가 작을수록 예후가 나쁘다는 것을 확인할 수 있었다. 하지만 두 연구와 달리 오직 우리 연구에서만 T1mi 하위 그룹에 대한 분류와 조사가 시행되었다. 연구의 주된 목적이 작은 종양 크기와 예후와의 연관성인 만큼 극소로 작은 T1mi 종양 크기에 대한 조사는 임상적으로 매우 중요하고 필수적인 의미를 갖고 있다고 할 수 있다.
뿐만 아니라, N2 환자 군에 국한되어 유의한 결과를 보인 Wo 등[7] 연구와 달리, 이번 연구의 경우 모든 림프절 전이 단계를 포함한 전체 환자 군에서 종양 크기가 더 작은 T1ab 그룹이 T1c보다 사망 발생 위험이 유의하게 증가하여, 임상적으로 더 의미 있는 결과를 도출했다. 또한 Wo 등[7] 연구에서는 암의 조직병리 종류가 침윤성 유관암에 국한되고 림프관-혈관 침습이나 인간 표피세포 성장인자 수용체 상태에 대한 조사가 이루어지지 않았던 것과 달리, 이번 연구에서는 침윤성 유관암, 침윤성 소엽암, 악성 필로데스 종양(malignant phyllodes tumor), 점액성 유방암(mucinous carcinoma), 유두암(papillary carcinoma) 등 다양한 종류의 유방암이 조사에 포함되었고, 림프관-혈관 침습과 인간 표피세포 성장인자 수용체 상태에 대한 다각도의 조사도 함께 이루어졌다.
또한 Houvenaeghel 등[9] 연구에서는 종양 크기 감소에 따른 전체 생존기간 감소만 확인할 수 있었고, Cox 다변수 분석에서 종양 크기에 따른 유의한 사망 위험 차이를 확인할 수 없었다. 반면 우리 연구에서는 Cox 다변수 분석에서도 명확히 작은 종양 크기의 사망 위험 증가를 확인할 수 있었다. 이러한 방법과 결과에서의 차이점은 우리 연구의 중요한 임상적 의의를 확인하게 해준다.
최근 여러 연구에서는 전이가 종양 진행의 늦은 시점에 발생한다는 기존의 연구에서 벗어나 종양 초기 단계에서 조기 전이가 나타나는 임상 연구 결과들이 나타나고 있다. Wang 등[26] 연구에서는 특정 유전자가 작은 크기의 유방암에서 전이 발생에 중요한 역할을 하고 있음을 언급하고 있다. Van’t Veer 등[27]과 Husemann 등[28] 연구에서는 세포 주기, 침습, 혈관생성, 신호 전달과 관련된 유전자가 존재한다고 언급하고 있다. 이러한 유전자는 생물학적으로 강한 공격성을 나타내고, 나쁜 예후와 연관되어 있으며 발현이 된 유방암의 경우 작은 크기 유방암에서 조기 전이 가능성 및 나쁜 예후 발생 가능성이 높아지는 것이다[28-30].
이번 연구를 통해, 매우 작은 크기의 유방암 환자에서 작은 종양 크기에서 나쁜 예후와 관련된 인자가 높은 비율로 분포하고, 작은 종양 크기에도 불구하고 조기에 림프절 침범을 하며, 이에 따른 생존기간 감소와 사망 위험도 증가의 결과가 나타날 수 있음을 알 수 있었다. 이는 작은 종양 크기 자체가 사망 위험을 높이는 중요한 예후 인자가 될 수 있으며, 생물학적 공격성을 나타내는 지표가 될 수 있음을 시사한다. 이는 최근의 다른 연구 결과에서 보았듯이, 생물학적 공격성을 나타내는 유전자가 존재함으로써 암의 빠른 진행과 조기 전이를 유발하는 것이다.
따라서 크기가 작은 유방암에서 이와 같은 공격적인 성향의 유방암을 감별하여 찾아낸다면 유방암 치료에 있어 더 좋은 결과를 가져올 수 있으며 환자에 좀 더 적합한 치료를 할 수 있다. 결론적으로 이번 연구에서 확인할 수 있었듯이, 작은 크기의 유방암에서 림프절 전이가 있는 경우, 공격성이 강한 유방암일지 모른다는 가능성을 염두에 두고 주의하여 적극적 치료를 해야 한다[31,32].
우리 연구는 몇 가지 한계점을 가진다. 첫 번째는 환자 수가 종양 크기 세부 그룹별로 차이가 많이 난다는 점이다. 이는 대등한 통계 분석 결과를 가져오기 힘들다. 또한 세부 그룹으로 나눌 때 각 세부 그룹의 환자 수가 적어서 역시 통계적인 유의성을 가져오기 힘들다.
또한 환자의 추적 관찰 기간이 62개월로 이는 비교적 짧은 기간에 속한다. 유방암의 경우 수술 후 10년까지 재발률이 존재하기 때문에 좀 더 오랜 기간의 추적 관찰 기간이 있다면 특히 예후가 주 조사 대상인 이번 연구에서 다른 결과를 가져올 수 있다.
따라서 이러한 한계점을 보완하여 좀 더 오랜 기간 동안 많은 수의 환자들을 대상으로 지속적인 연구를 이어간다면 훨씬 명확하고 의미 있는 양질의 연구 결과를 기대할 수 있을 것이다.
Figure 2.Overall survival according to tumor size group (categorized by 1 cm size difference) in all patients. 
Figure 3.Overall survival according to tumor size group (categorized by 1 cm size difference) in T1N1 patients. 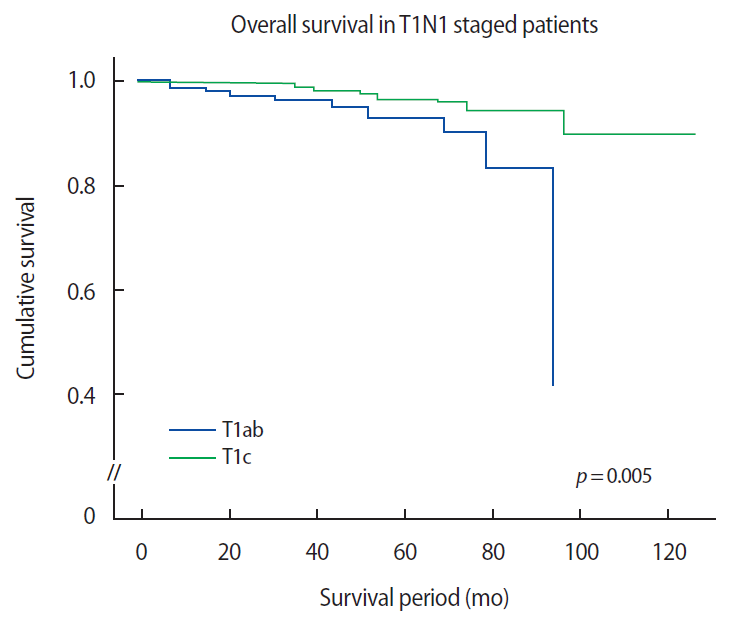
Table 1.Characteristics of patient and tumor according to tumor size (categorized by 1 cm size difference)
Table 2.Status of the 13 expired patients with tumor less than 1 cm size who died LN=lymph node; LVI=lymphovascular invasion; CTx=chemotherapy; RTx=radiotherapy; HTx=hormone therapy; BCS=breast-conserving surgery; ALND=axillary lymph node dissection; IDC=invasive ductal carcinoma; N=no; TM=total mastectomy; HER2=human epidermal growth factor receptor 2; ILC=invasive lobular carcinoma. Table 3.Relative risk in multivariate Cox proportional hazards model from overall data REFERENCES1. Fowble BL, Schultz DJ, Overmoyer B, Solin LJ, Fox K, Jardines L, et al. The influence of young age on outcome in early stage breast cancer. Int J Radiat Oncol Biol Phys 1994;30:23-33.
2. Slamon DJ, Clark GM, Wong SG, Levin WJ, Ullrich A, McGuire WL. Human breast cancer: correlation of relapse and survival with amplification of the HER-2/neu oncogene. Science 1987;235:177-8.
3. Perou CM, Sørlie T, Eisen MB, van de Rijn M, Jeffrey SS, Rees CA, et al. Molecular portraits of human breast tumours. Nature 2000;406:747-52.
4. Greene FL, Page DL, Fleming ID, Fritz AG, Balch CM, Haller DG, et al. AJCC Cancer Staging Manual. 2nd ed. Chicago: Springer; 2002.
5. Gajdos C, Tartter PI, Bleiweiss IJ. Lymphatic invasion, tumor size, and age are independent predictors of axillary lymph node metastases in women with T1 breast cancers. Ann Surg 1999;230:692-6.
6. Lyu Z, Wang J, Kang L, Hu C, He H, Guan M, et al. Lymph node metastasis and prognostic analysis of 354 cases of T1 breast cancer. Zhonghua Zhong Liu Za Zhi 2014;36:382-5.
7. Wo JY, Chen K, Neville BA, Lin NU, Punglia RS. Effect of very small tumor size on cancer-specific mortality in node-positive breast cancer. J Clin Oncol 2011;29:2619-2.
8. Broekhuizen LN, Wijsman JH, Peterse JL, Rutgers EJ. The incidence and significance of micrometastases in lymph nodes of patients with ductal carcinoma in situ and T1a carcinoma of the breast. Eur J Surg Oncol 2006;32:502-6.
9. Houvenaeghel G, Goncalves A, Classe JM, Garbay JR, Giard S, Charytensky H, et al. Characteristics and clinical outcome of T1 breast cancer: a multicenter retrospective cohort study. Ann Oncol 2014;25:623-8.
10. Shoup M, Malinzak L, Weisenberger J, Aranha GV. Predictors of axillary lymph node metastasis in T1 breast carcinoma. Am Surg 1999;65:748-52.
11. Brenin DR, Manasseh DM, El-Tamer M, Troxel A, Schnabel F, Ditkoff BA, et al. Factors correlating with lymph node metastases in patients with T1 breast cancer. Ann Surg Oncol 2001;8:432-7.
12. Markopoulos C, Kouskos E, Gogas H, Mandas D, Kakisis J, Gogas J. Factors affecting axillary lymph node metastases in patients with T1 breast carcinoma. Am Surg 2000;66:1011-3.
13. Ko BS, Lim WS, Kim HJ, Yu JH, Lee JW, Kwan SB, et al. Risk factor for axillary lymph node metastases in microinvasive breast cancer. Ann Surg Oncol 2012;19:212-6.
14. Ichizawa N, Fukutomi T, Iwamoto E, Akashi-Tanaka S. Long-term results of T1a, T1b and T1c invasive breast carcinomas in Japanese women: validation of the UICC T1 subgroup classification. Jpn J Clin Oncol 2002;32:108-9.
15. Meyer JS, Fahrner M, Daniel FC. Pathology and behavior of small breast carcinomas. Semin Diagn Pathol 1999;16:257-68.
16. Wasif N, Maggard MA, Ko CY, Giuliano AE. Invasive lobular vs. ductal breast cancer: a stage-matched comparison of outcomes. Ann Surg Oncol 2010;17:1862-9.
18. Giuliano AE, Barth AM, Spivack B, Beitsch PD, Evans SW. Incidence and predictors of axillary metastasis in T1 carcinoma of the breast. J Am Coll Surg 1996;183:185-9.
19. Jatoi I, Chen BE, Anderson WF, Rosenberg PS. Breast cancer mortality trends in the United States according to estrogen receptor status and age at diagnosis. J Clin Oncol 2007;25:1683-90.
20. Pagani O, Price KN, Gelber RD, Castiglione-Gertsch M, Holmberg SB, Lindtner J, et al. Patterns of recurrence of early breast cancer according to estrogen receptor status: a therapeutic target for a quarter of a century. Breast Cancer Res Treat 2009;117:319-24.
21. Bulut N, Altundag K. Does estrogen receptor determination affect prognosis in early stage breast cancers? Int J Clin Exp Med 2015;8:21454-9.
22. Sato K, Miyashita M, Ishida T, Suzuki A, Tada H, Watanabe G, et al. Prognostic significance of the progesterone receptor status in Ki67-high and -low Luminal B-like HER2-negative breast cancers. Breast Cancer 2016;23:310-7.
23. Kaplan HG, Malmgren JA, Atwood M. T1N0 triple negative breast cancer: risk of recurrence and adjuvant chemotherapy. Breast J 2009;15:454-60.
24. Kim H, Cho J, Kwon SY, Kang SH. Biologic subtype is a more important prognostic factor than nodal involvement in patients with stages I and II breast carcinoma. Ann Surg Treat Res 2016;90:1-9.
25. Lauria R, Perrone F, Carlomagno C, De Laurentiis M, Morabito A, Gallo C, et al. The prognostic value of lymphatic and blood vessel invasion in operable breast cancer. Cancer 1995;76:1772-8.
26. Wang H, Arun BK, Wang H, Fuller GN, Zhang W, Middleton LP, et al. IGFBP2 and IGFBP5 overexpression correlates with the lymph node metastasis in T1 breast carcinomas. Breast J 2008;14:261-7.
27. van ‘t Veer LJ, Dai H, van de Vijver MJ, He YD, Hart AA, Mao M, et al. Gene expression profiling predicts clinical outcome of breast cancer. Nature 2002;415:530-6.
28. Hüsemann Y, Geigl JB, Schubert F, Musiani P, Meyer M, Burghart E, et al. Systemic spread is an early step in breast cancer. Cancer Cell 2008;13:58-68.
29. Sørlie T, Perou CM, Tibshirani R, Aas T, Geisler S, Johnsen H, et al. Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications. Proc Natl Acad Sci U S A 2001;98:10869-74.
30. Schmidt-Kittler O, Ragg T, Daskalakis A, Granzow M, Ahr A, Blankenstein TJ, et al. From latent disseminated cells to overt metastasis: genetic analysis of systemic breast cancer progression. Proc Natl Acad Sci U S A 2003;100:7737-42.
31. Schmidt-Ullrich RK, Wazer DE, DiPetrillo T, Marchant DJ, Smith TJ, Safaii H, et al. Breast conservation therapy for early stage breast carcinoma with outstanding 10-year locoregional control rates: a case for aggressive therapy to the tumor bearing quadrant. Int J Radiat Oncol Biol Phys 1993;27:545-52.
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||