AbstractPurpose:The relationship between neoadjuvant chemotherapy (NAC) and body mass index (BMI) in breast cancer patients has been reported in many studies. Which have suggested that obesity is associated with a poor prognosis in breast cancer patients in Western countries, but not in breast cancer patients from Asian countries. We studied the relationship between response to chemotherapy, survival and BMI.
Methods:A total of 217 Korean breast cancer patients were enrolled in the study, and 170 underwent magnetic resonance imaging scan prior to chemotherapy. The BMI of the patients was calculated using their age, weight, and height. The following factors were analyzed: chemotherapy regimen, tumor size before and after NAC, surgical procedure, pathological tumor size, lymph node status, nuclear grade, histological grade, hormone receptor status, and epidermal growth factor receptor expression. Disease-free survival (DFS) and overall survival (OS) were determined using recent medical records. According to the World Health Organization’s classification of BMI, patients were divided into four groups: ≤18.5, underweight; 18.5 to 24.9, normal weight; 25 to 29.9, overweight; ≥30, obesity. The underweight and normal weight patients were combined to from group A, whereas the overweight and obese patients were combined to from group B. DFS and OS were calculated using the Kaplan-Meier method.
Results:In this study, there were 113 patients (66.5%) in group A, and 57 patients (33.5%) in group B. When the two groups were compared, age was the only factor that showed a statistically significant difference. Clinical complete remission (p=0.98), pathological complete remission (p=0.63), OS (p=0.64), and DFS (p=0.10) did not correlate with BMI.
서 론세계 암 통계인 GLOBOCAN 2008에 의하면 유방암은 세계 여성 암 중 발생률 1위로, 새로 발생한 여성암의 23%, 전체 여성 암 사망의 14%를 차지한다[1]. 최근 우리나라에서 유방암은 꾸준한 증가 추세를 보이며 자궁경부암을 제치고 갑상선암 다음으로 높은 발생률을 보이고 있다. 2011년에 보고된 국가암등록사업 연례보고서에 따르면, 2009년 우리나라에서 발생한 유방암은 약 13,400건으로 인구 10 만명당 54명의 유방암이 발생하여 전체 여성암의 19.8%를 차지하였다[2]. 이는 점차 서구화되는 우리나라의 식생활과 생활 패턴의 변화에서 기인하는 것으로 생각되고 있다. 그리고 우리나라 사람들의 식생활 변화와 함께 최근 비만 환자가 급증하고 있으며 비만은 각종 성인병의 중요한 위험인자로서 많은 사람들이 관심을 갖는 중대한 건 강문제로 인식하게 되었다. 또한 유방암 발생의 위험인자 및 예후인자로서도 비만에 관한 많은 연구가 보고된 바 있다.
유방암 예후를 결정하는 인자들은 종양의 크기, 림프절 전이 여부, 병기, 핵등급, 조직학적 등급, 여성 호르몬 수용체 발현 여부, 표피성장인자 수용체 과발현 여부 등으로 알려져 있다[3,4]. 이 외에 비만도 유방암의 발생률을 높이며, 재발률을 증가시킬 수 있다는 연구 결과도 있다[5,6]. 체질량지수(body mass index, BMI)는 비교적 정확하게 체지방의 정도를 반영할 수 있어 비만 지표로 많이 이용되고 있다[7]. 그동안 발표된 연구들에 따르면 높은 BMI는 유방암 환자에서 불량한 예후와 관련이 있다고 알려져 있으며, 비만한 경우 혈액 내 높은 농도의 여성호르몬, 인슐린, 인슐린성장인자가 다양한 메커니즘을 통해 유방암의 성장을 촉진한다고 한다[8-11]. 그리고 비만일 경우에 종양의 T병기와 N병기가 더 높은 경향을 보이며, 상대적으로 발견이 어려우므로 진단이 늦어지는 경우도 많다고 보고된 바 있다[12,13]. 반대로 비만은 유방암 예후와 연관이 없다는 보고도 있다[14].
선행항암화학요법이 1970년대에 처음 시도된 이후 종양의 크기를 줄여 유방보존수술이 가능한 환자가 증가하면서 유방암 환자의 삶의 질이 향상되었으며 일부에서는 생존기간 연장의 효과를 얻게 되었다. 최근 중국의 유방암 환자를 대상으로 한 Chen 등[15]의 연구에 따르면 과체중 이상은 선행항암화학요법을 받았을 때 병리학적 관해율이나 생존율에서 서양의 유방암 환자와 마찬가지로 불량한 결과를 보인다고 보고하였다. 그러나 한국의 유방암 환자를 대상으로 한 Lee 등[16]의 연구에 따르면 체중은 선행항암화학요법 이후에 병리학적 관해율이나 생존율과 관련이 없다는 결과를 발표한 바 있다.
이에 본 연구에서는 한국의 단일기관에서 선행항암화학요법을 받은 유방암 환자를 대상으로 BMI와 치료의 반응, 생존율이 어떠한 연관성을 가지고 있는지에 대해 알아보고자 하였다.
방 법연구 대상이 연구는 의무기록 조사를 통한 후향적 연구로서 2001년부터 2013년까지 아주대학교병원에서 선행항암화학요법을 받고 수술을 시행한 유방암 환자 217명을 대상으로 하였으며, 이 중 항암치료 후 반응평가를 비교하기 위한 자기공명영상검사를 선행항암화학요법 전에 시행했던 170명의 환자를 분석하였다. 환자의 체중과 신장을 통하여 BMI를 계산하고, 이 밖에 나이, 선행항암화학요법의 종류, 항암치료 전과 후의 종양의 크기 변화, 수술 방법, 수술 후 병리학적 종양의 크기, 종양의 호르몬 수용체 여부 등을 분석하였으며 최근 진료기록을 통해 무병생존율 및 생존율을 구하였다. BMI는 체중(kg)을 신장의 제곱(㎡)으로 나눈 값이다. 세계보건기구(World Health Organization, WHO)의 BMI 분류에 따라 BMI가 18.5 미만은 저체중; 18.5–24.9은 정상체중; 25–29.9은 과체중; 30 이상은 비만으로 나누었다[7].
치료효과의 평가환자는 선행항암화학요법으로 anthracycline 투여군과, anthracycline에 taxane을 추가한 그룹으로 나누었다. 모든 환자는 항암치료를 완료한 후 유방 보존술이나 유방 전절제술을 받았으며, 수술 중 감시림프절생검술 혹은 액와부림프절곽청술을 시행받았다. 선행항암화학요법에 대한 반응 평가는 항암치료 전후의 자기공명영상검사에서 측정한 암의 크기(mm) 및 림프절의 크기(mm)를 비교하였다. Response Evaluation Criteria in Solid Tumors (RECIST) 1.1 [17]에 따라 임상적 완전관해는 치료 전 확인되었던 병변이 완전히 소실된 상태, 임상적 부분관해는 치료 후 암의 크기가 30% 이상 감소한 상태, 임상적 안정병변은 치료 후 암의 크기가 30% 미만으로 감소하거나 20% 미만으로 증가한 상태, 임상적 진행병변은 암의 크기가 20% 이상 증가한 것으로 정의하였다.
병리학적 검사모든 병리학적 평가는 아주대학교병원에서 2명의 병리학자가 분석하였다. 유방암의 진단은 항암치료를 받기 전에 총생검술에 의해 확인되었다. 유방암 조직은 선행항암화학요법을 받기 전에 채취한 표본과 수술 후 조직표본 모두 포르말린에 고정하고 hematoxylin-eosin (H&E) 염색으로 확인하였으며, 조직학적 유형은 WHO 분류에 따라 분류하였다. 에스트로겐 수용체(estrogen receptor), 프로게스테론 수용체(progesterone receptor) 및 인간표피성장인자 수용체 2 (human epidermal growth factor receptor 2) 등에 대한 발현은 면역조직화학염색으로 확인하였다. 병리학적 완전관해는 수술 후 검체에서 종양세포가 완전히 소실된 상태로 정의하였다. 환자의 TNM 병기는 American Joint Committee on Cancer 7판을 기준으로 분석하였다.
통계 및 분석환자의 특성은 BMI를 기준으로 저체중과 정상체중은 group A로 과체중과 비만은 group B로 나누어 카이제곱검정을 사용하여 비교하였다. 환자의 전체 생존기간(overall survival)은 수술일로부터 마지막 방문일까지의 기간으로 계산하고, 무병 생존기간(relapse-free survival)은 수술일로부터 재발 여부가 확인된 날까지로 계산하였다. 전체 생존율과 무병 생존율을 Kaplan-Meier 방법으로 산출하였다. 통계적 유의성은 log-rank test를 통해 p값이 0.05 미만인 경우 통계적 의의가 있는 것으로 검증하였으며 상대위험도의 분석은 Cox regression hazard model을 사용하였고, 모든 통계처리는 SPSS 19.0 프로그램(SPSS Inc., Chicago, USA)으로 하였다.
결 과임상 병리학적 특성선행항암화학요법을 받은 170명의 유방암 환자에서 항암치료 전의 BMI 평균값은 23.9±3.28이었다. 이 중 저체중은 1.7% (n=3), 정상체중은 64.7% (n=110), 과체중은 30.6% (n=52), 비만은 3.0% (n=5)이었다. 저체중과 정상체중을 group A로 분류하고 과체중과 비만을 group B로 분류하였다. 이에 따라 group A는 113명(66.5%), group B는 57명(33.5%)이었으며, 모두 여성 환자이고 평균 나이는 47.4±9.56였다. Group A의 평균 나이는 46.30±8.56이며 group B의 평균나이는 49.5±11.0로 통계적으로 유의한 차이를 보였다(p=0.04). 이 밖에도 유방암의 예후와 연관이 있는 종양 크기, 림프절 전이 여부, 병기, 핵등급, 조직등급, 여성 호르몬 수용체 발현 여부, 표피성장인자 수용체 과발현 여부 등에서는 차이를 보이지 않았다(Table 1).
BMI와 생존율전체 생존기간은 21.9±16.3개월이며 group A에서 생존기간은 21.8±15.6개월, group B에서 생존기간은 22.0±17.8개월이었다. 사망한 환자는 10명이었고, 국소재발 및 원격전이를 포함한 재발환자는 30명이었다. 전체 생존자는 group A에서 107명(94.7%)이었고, group B에서는 53명(93.0%)이었으며(p=0.64), 무병 생존자는 group A에서 89명(78.8%), group B에서는 51명(89.5%)으로 통계적으로 유의한 차이는 보이지 않았다(p=0.10). 또한 각 그룹별로 전체 생존율(p=0.650)과 무병 생존율(p=0.094)을 비교하였을 때도 의미 있는 차이는 없었다(Figures 1, 2).
고 찰본 연구에서는 비만이 유방암의 발병요인으로 알려져 있는 것과는 달리 한국인 유방암 환자에서는 비만과 치료반응 및 예후가 크게 관련이 없는 것으로 확인되었다. 현재 유방암은 한국 여성에서 발생하는 암 중 두 번째로 높은 빈도를 보이는 암으로서 점차 관심도도 증가하고 있는 상황이다. 이에 따라 유방암의 위험인자를 밝혀 이를 예방하거나 조기에 발견하려는 노력이 이루어지고 있다. 기존에 알려진 유방암의 발병요인으로 출산 경험이 없는 여성, 빠른 초경 연령, 늦은 폐경 연령, 불규칙한 월경주기 등 임신, 분만과 관련된 생식요인이 있으며, 고칼로리식, 사춘기와 폐경 후의 비만 등 식이와 관련된 요인, 과거 양성 유방질환의 과거력, 직계가족 중 유방암 환자 과거력 등이 알려져 있다[18].
비만은 체내에 지방이 과다하게 축적된 상태를 말하며 에너지 섭취와 소비의 불균형 때문인 것으로 생각되며 각종 성인병의 중요한 요인일 뿐 아니라 수명을 단축시키는 중대한 건강문제로 유전적, 환경적 요인들과도 관련되어 있다[19]. 또한 유방암 발생의 위험인자 중 하나로서도 비만에 관한 많은 연구가 이루어져왔고 보고된 바로는 비만이 유방암 환자에 있어서 좋지 않은 예후 인자로 인지되고 있다[8,9]. 그리고 중국 여성 유방암 환자를 대상으로 한 연구에서도 과체중이나 비만인 경우, 병리학적 관해율이나 생존율이 낮게 보고되어 동양 여성에서도 비만이 예후에 부정적 영향을 미칠 수 있음을 시사하였다[15].
인종과 국가에 따라 식이습관과 체형이 다르고 비만을 정의하는 기준이 조금씩 다르므로 외국의 연구 결과가 국내 유방암 환자에 있어서도 항상 일률적으로 적용될 수는 없을 것이다. 그리고 실제로 국내 유방암 환자를 대상으로 한 비만 정도와 유방암 발생 및 그 예후인자로서의 영향에 대한 문헌은 매우 드물다. 최근 한국 여성 유방암 환자를 대상으로 분석해본 결과, 체중과 선행항암화학요법 후 병리학적 관해율이나 생존율과는 크게 연관성이 없다는 결과가 도출되었다[16].
본 연구에서 비만을 정의하는 기준으로 사용된 BMI는 남녀에 공통으로 사용할 수 있고 실제 체지방을 잘 반영하면서도 체중을 신장의 제곱치로 나눈 값(kg/m2)으로 구할 수 있어 매우 간단한 방법으로 실제 비만에 관한 역학조사에서 흔히 이용되고 있다[20]. BMI는 연령과 밀접한 관련이 있는 것으로 알려져 있으며 연령이 증가할수록 함께 증가하는 것으로 알려져 있는데[19], 본 연구 결과에서도 한국 유방암 환자에서 과체중인 group B는 group A에 비해서 의미있게 연령이 높은 것으로 나타났다(p=0.04). 그리고 많은 유사한 연구들에서 높은 BMI를 보인 환자군에서 종양 크기, 종양 병기, 액와림프절 전이가 많음을 보고하고 있지만[21], 본 연구에 있어서는 전혀 연관성을 보이지 않았다. BMI 증가에 따른 종양 크기, 종양 병기, 액와림프절 전이의 증가 등은 비만한 여성에서 나쁜 예후를 보이는 이유로 생각된다. 유방암의 에스트로겐 수용체 발현과 BMI는 연구자에 따라 다양하게 보고하고 있는데 높은 BMI를 보이는 유방암 환자에서 에스트로겐 또는 프로게스테론 등의 호르몬 수용체 발현이 적게 된다는 연구[22-24]와 함께 본 연구와 같이 연관성이 없다는 보고도 있다[25].
서양인 환자를 대상으로 한 연구들 중 BMI와 유방암의 예후와 관련이 있다는 결과와 다른 결과가 도출된 것은, 한국인의 특성상 고도비만 환자군이 서양인에 비해 비교적 적어 대부분의 환자들의 BMI가 큰 차이를 보이지 않는다는 특징도 본 연구 결과를 뒷받침하는 근거라 할 수 있겠다[26,27]. 또한 단일기관의 후향적 연구라는 한계점이 있어 환자 수가 적고 항암치료기간 중 변화하는 BMI를 정확히 반영하지 못하였으며, 추적기간이 짧았다는 점도 연구의 제한점으로 남아있다.
본 연구를 통해 선행항암화학요법을 받은 한국인 유방암 환자에서 BMI는 완전 관해율 및 생존율에 큰 영향을 미치지 않는 것으로 확인되었다. 이 결과는 한국인의 유방암과 관련한 예후인자가 서양의 것과 다를 수 있음을 시사하는 것이라 할 수 있겠다.
Figure 1.Kaplan-Meier survival curves for overall survival in groups A and B. No significant difference of overall survival between groups A and B. 
Figure 2.Kaplan-Meier survival curves for relapse-free survival in groups A and B. No significant difference of relapse-free survival between groups A and B. 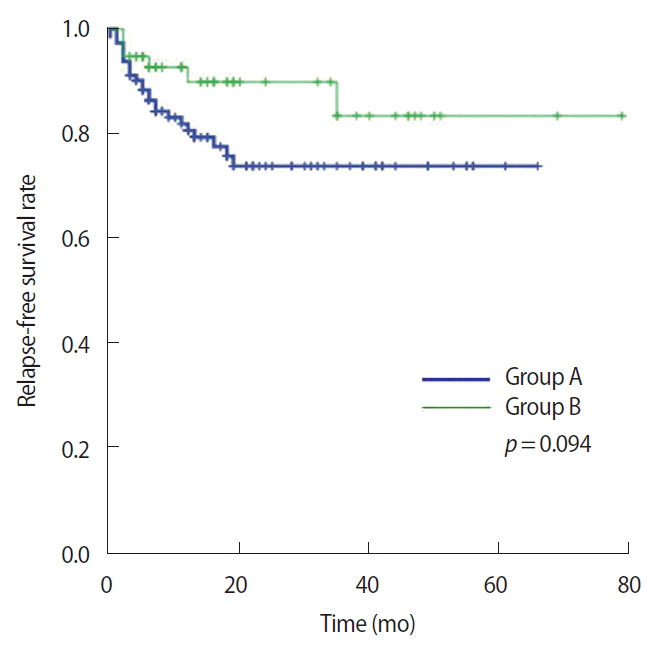
Figure 3.Kaplan-Meier survival curves for overall survival of subgroups according to hormone receptor status. (A) Overall survival curves of hormone receptor positive subgroups. (B) Hormone receptor negative subgroups. 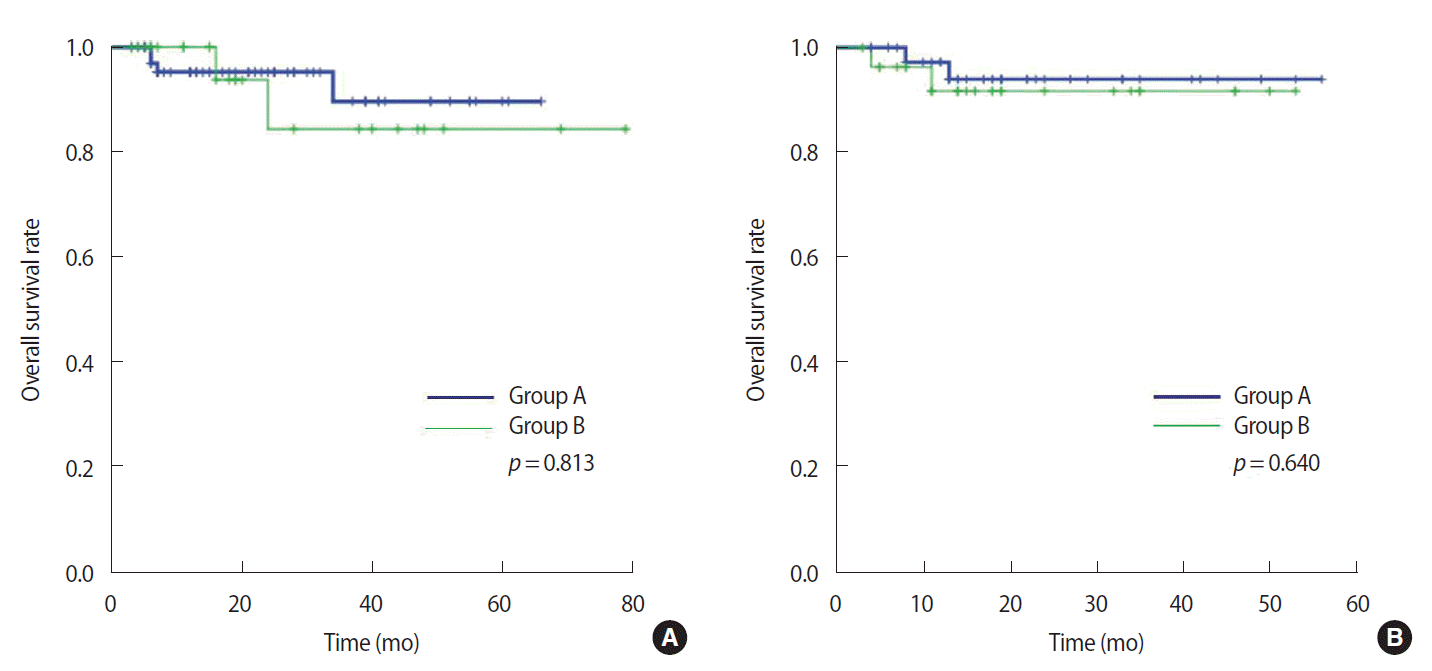
Figure 4.Kaplan-Meier survival curves for relapse-free survival of subgroups according to hormone receptor status. (A) Relapse-free survival curves of hormone receptor positive subgroups. (B) Hormone receptor negative subgroups. 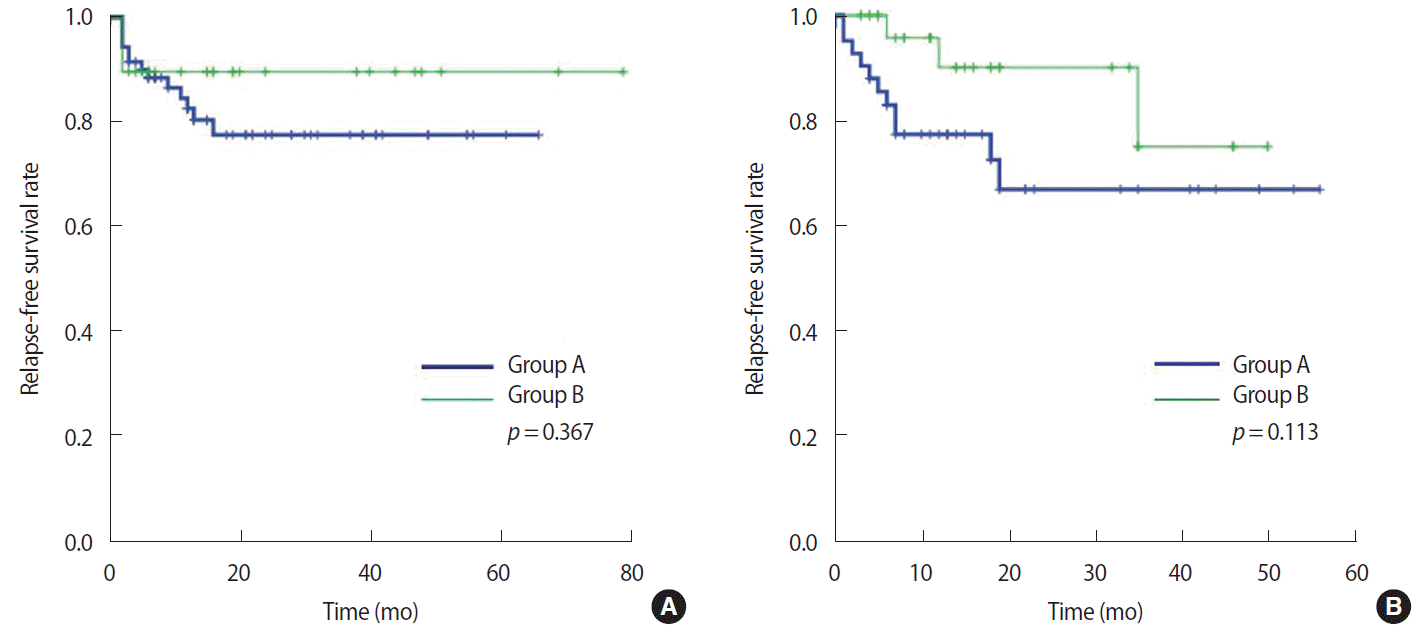
Table 1.Patients characteristics
Table 2.Factors predictive of pathologic complete or partial response to neoadjuvant chemotherapy Table 3.Clinical response to neoadjuvant chemotherapy
REFERENCES1. Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D. Global cancer statistics. CA Cancer J Clin 2011;61:69-90.
2. The Korea Central Cancer Registry. Annual Report of Cancer Statistics in Korea in 2009. Goyang: The Korea Central Cancer Registry; 2011.
3. Cianfrocca M, Goldstein LJ. Prognostic and predictive factors in early-stage breast cancer. Oncologist 2004;9:606-16.
4. Slamon DJ, Clark GM, Wong SG, Levin WJ, Ullrich A, McGuire WL. Human breast cancer: correlation of relapse and survival with amplification of the HER-2/neu oncogene. Science 1987;235:177-82.
5. van den Brandt PA, Spiegelman D, Yaun SS, Adami HO, Beeson L, Folsom AR, et al. Pooled analysis of prospective cohort studies on height, weight, and breast cancer risk. Am J Epidemiol 2000;152:514-27.
6. Morimoto LM, White E, Chen Z, Chlebowski RT, Hays J, Kuller L, et al. Obesity, body size, and risk of postmenopausal breast cancer: the Women’s Health Initiative (United States). Cancer Causes Control 2002;13:741-51.
7. WHO Expert Consultation. Appropriate body-mass index for Asian populations and its implications for policy and intervention strategies. Lancet 2004;363:157-63.
8. Bastarrachea J, Hortobagyi GN, Smith TL, Kau SW, Buzdar AU. Obesity as an adverse prognostic factor for patients receiving adjuvant chemotherapy for breast cancer. Ann Intern Med 1994;120:18-25.
9. Carmichael AR. Obesity as a risk factor for development and poor prognosis of breast cancer. BJOG 2006;113:1160-6.
10. Goodwin PJ, Ennis M, Pritchard KI, Trudeau ME, Koo J, Madarnas Y, et al. Fasting insulin and outcome in early-stage breast cancer: results of a prospective cohort study. J Clin Oncol 2002;20:42-51.
11. McTiernan A, Rajan KB, Tworoger SS, Irwin M, Bernstein L, Baumgartner R, et al. Adiposity and sex hormones in postmenopausal breast cancer survivors. J Clin Oncol 2003;21:1961-6.
12. Cui Y, Whiteman MK, Flaws JA, Langenberg P, Tkaczuk KH, Bush TL. Body mass and stage of breast cancer at diagnosis. Int J Cancer 2002;98:279-83.
13. Zumoff B, Dasgupta I. Relationship between body weight and the incidence of positive axillary nodes at mastectomy for breast cancer. J Surg Oncol 1983;22:217-20.
14. Dignam JJ, Wieand K, Johnson KA, Raich P, Anderson SJ, Somkin C, et al. Effects of obesity and race on prognosis in lymph node-negative, estrogen receptor-negative breast cancer. Breast Cancer Res Treat 2006;97:245-54.
15. Chen S, Chen CM, Zhou Y, Zhou RJ, Yu KD, Shao ZM. Obesity or overweight is associated with worse pathological response to neoadjuvant chemotherapy among Chinese women with breast cancer. PLoS One 2012;7:e41380.
16. Lee KH, Keam B, Im SA, Kim TY, Han SW, Oh DY, et al. Body mass index is not associated with treatment outcomes of breast cancer patients receiving neoadjuvant chemotherapy: Korean data. J Breast Cancer 2012;15:427-33.
17. Eisenhauer EA, Therasse P, Bogaerts J, Schwartz LH, Sargent D, Ford R, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer 2009;45:228-47.
18. The Korean Breast Cancer Society. The Breast. 1st ed. Seoul: Ilchokak; 1999. p 128-9.
19. Bae MK, Lee WK, Song CH, Lee KM, Jung SP. The factors associated with body mass index of adults. J Korean Acad Fam Med 1999;20:906-16.
20. Health implications of obesity. National Institutes of Health Consensus Development Conference Statement. Ann Intern Med 1985;103(6 Pt 2):1073-77.
21. Newman SC, Lees AW, Jenkins HJ. The effect of body mass index and oestrogen receptor level on survival of breast cancer patients. Int J Epidemiol 1997;26:484-90.
22. Männistö S, Pietinen P, Pyy M, Palmgren J, Eskelinen M, Uusitupa M. Body-size indicators and risk of breast cancer according to menopause and estrogen-receptor status. Int J Cancer 1996;68:8-13.
23. Ruder AM, Lubin F, Wax Y, Geier A, Alfundary E, Chetrit A. Estrogen and progesterone receptors in breast cancer patients: epidemiologic characteristics and survival differences. Cancer 1989;64:196-202.
24. Giuffrida D, Lupo L, La Porta, La Rosa, Padova G, Foti E, et al. Relation between steroid receptor status and body weight in breast cancer patients. Eur J Cancer 1992;28:112-5.
25. Howson CP, Kinne D, Wynder EL. Body weight, serum cholesterol, and stage of primary breast cancer. Cancer 1986;58:2372-81.
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||