AbstractPurposeThis study aimed to determine the correlation between various clinical results, including recurrence in patients with breast cancer, and preoperative blood composition ratio and postoperative pathological results.
MethodsA total of 444 patients who underwent surgery were included, and the neutrophil-to-lymphocyte ratio (NLR), platelet-to-lymphocyte ratio (PLR), monocyte-to-lymphocyte ratio (MLR), and postoperative pathological results were classified into postoperative cancer stages to confirm the association with various clinical results, including recurrence.
ResultsThe median age of the patients was 51 years. The stages were divided into 1, 2, 3, and 4. Additionally, stages 1 and 2 comprised one group and stages 3 and 4 comprised another group. The cut-off values of the NLR, PLR, and MLR were confirmed to be 1.43, 158.84, and 0.21, respectively. It was noted that the association with recurrence was higher in the group with hormone receptor negative (p<0.001), higher stage (p<0.001), and underwent neoadjuvant chemotherapy (p<0.001). In the association with blood composition ratio and recurrence, survival was high in the PLR group with a high cut-off value (p=0.004). There was no significant relationship in the NLR and MLR groups. In the disease-free survival and overall-survival curves, only the PLR group showed a significant association of 0.003 and 0.001, respectively. The NLR and MLR groups did not show any significant result.
서 론유방암은 여성들에게 가장 많이 발생하는 암으로서, 미주 및 유럽뿐만 아니라 한국을 포함한 전세계 여성의 삶의 질에 큰 영향을 미치고 있다[1]. 유방암의 치료는 근치절제를 포함하는 수술과 호르몬치료, 항암치료, 방사선치료 등의 다양한 방법이 있으며, 최근에는 여러 가지 표적치료, 면역치료의 방법도 있다. 다양한 치료방법을 환자에게 적용할 수 있는 것은 끊임없이 발전하는 기술의 발전으로 가능하였고, 호르몬수용체(estrogen receptor, progesterone receptor), 인간표피성장인자수용체-2 (human epidermal growth factor receptor-2, HER-2), 다양한 면역체계와 관련된 치료가 그 예라 할수있겠다. 유방암의 예후는 환자의 나이, 병기, 다양한 생물학적 인자를 통하여 구분이 된다[2,3]. 또한, 선행항암화학치료 후 환자의 말초혈액의 림프구의 수는 환자의 면역수준을 반영하는 인자로도 알려져 있다[4]. 종양 미세환경으로 범위를 좁혔을 때에도 염증세포 및 매개인자들이 종양의 진화에 중요한 역할을 하는 것으로 알려져 있으며[5], 다양한 혈액구성 인자의 비율은 그 상태에 따라 예후의 좋고 나쁨을 예측할 수 있다고 알려져 있다[6-9]. 이러한 수술 전후의 여러가지 요인들의 차이로 인한 결과는 재발 및 생존과 연관이 되어있다. 유방암환자에서 재발의 여부에 따라 삶의 질에 큰 영향을 미치게 되며[10], 전신전이의 시작점으로도 알려져 있어 환자 및 의료진에 커다란 저항이 되고 있다. 재발은 국소구역에 국한된 경우와, 전이와 같은 전신재발로 구분할 수 있겠다. 이러한 재발의 형태에 따라 환자의 상황에 맞는 여러 가지 치료 방법을 선택해야 할 것이며, 또한 재발이 발생하기 전에 예측하는 것도 매우 중요한 것이라고 할 수 있겠다[11]. 이에 본 연구는 수술 전 시행하는 기본 검사를 토대로 좀 더 수월하게 수술 후의 결과에 대해 예측할 수 있는 방법을 알아보고자 수술 전 환자의 혈액구성 비율에 따라 수술 후 결과 및 재발, 생존과 어떤 연관성이 있는지 확인해보고자 하였다.
방 법2012년에서 2016년 사이 유방암으로 수술을 시행한 444명의 환자를 대상으로 의무기록을 후향적으로 분석하였다. 암 병기는 미국 암합동위원회(American Joint Committee on Cancer, AJCC) 7판을 기준으로 하였다. 구분한 병기에 따라 유방암과 관련된 수술 후 병리결과를 확인하고 유방암 관련 생존, 국소 구역에 국한된 경우의 재발, 타 장기에서의 전신 재발인 전이를 분석하였으며 수술 후 반대측 유방으로의 재발은 본 연구의 사례에서는 없었다. 또한 수술 전 환자의 혈액검사 결과에 따른 호중구-림프구 비율(neutrophil-to-lymphocyte ratio, NLR), 혈소판-림프구비율(platelet-to-lymphocyte ratio, PLR), 단핵구-림프구 비율(monocyte-to-lymphocyte ratio, MLR)을 확인하였으며 민감도와 특이도의 평균을 최대화하기 위해 receiver operating characteristics (ROC) 곡선을 바탕으로 Youden Index cut-off value를 설정하였다(Figure 1). 통계는 SPSS 25.0 (IBM, Armonk, USA)을 사용하였고, 무병생존과 관련된 수술 전 혈액구성 비율 및 수술 후 병리결과와의 분석을 위해 Cox-regression 모델을 사용하였다. 또한 Kaplan-Meier 곡선을 이용하여 수술 전 혈액구성 비율에 따른 전체생존율 및 무병생존율을 분석하였다. 본 연구는 IRB 승인을 득한 후 진행하였다(IRB No. 2021-06-045).
결 과먼저, 연구대상자의 수술 전 혈액검사를 토대로 NLR, PLR, MLR의 cut-off를 기준으로 하여 환자의 정보를 나열하였다. 전체 444명의 환자를 대상으로 하였고, 나이는 25세에서 88세까지 분포하였고 평균값 51.37세, 표준편차 ±10.46세였다. 폐경 전 여성이 287명(64.64%), 폐경 후 여성이 157명(35.36%)였다. 병소의 위치는 우측이 205명(46.17%), 좌측이 239명(53.83%)이었다. 수술 방법으로는 유방보존술 310건(69.82%), 유방전절제술 110건(24.77%) 및 유방전절제 후 즉시재건술이 24건(5.41%)으로 시행을 하였다(Table 1).
수술 후 병리조직 결과는 다음과 같았다. 암의 조직분류로는 침윤성 유관암이 412명(92.79%)으로 거의 대부분을 차지하고 있었으며, 침윤성소엽암이 12명(2.7%), 수질암, 점액암 등을 포함한 기타 암은 20명(4.5%)이었다. 암세포의 크기는 평균 2.47 cm이었으며, Table에는 표기하지 않았으나, T병기에서는 T1이 248명(55.86%), T2가 170명(38.29%), T3가 22명(4.95%), T4가 4명(0.9%)이었다. N병기에서는 N0가 286명(64.41%), N1, N2, N3가 각각 105명(23.65%), 30명(6.76%), 23명(5.18%)이었다. 병기는 1, 2, 3, 4 각각 그리고 그룹을 단순화하기 위해 1, 2를 한 그룹으로 3, 4를 또 다른 한 그룹으로 묶어 결과를 구분하였다. 병기 1, 2, 3, 4 각각으로는 214명(48.2%), 165명(37.16%), 61명(13.74%), 4명(0.9%)이었으며, p 값의 유의미성은 확인할 수 없었다. 다만, 1기와 2기를 한 그룹으로 묶은 결과에서는 379명(85.36%), 3기와 4기를 묶은 결과에서는 65명(14.64%)이었으며, 혈소판-림프구 비율 및 호중구-림프구 비율 연관성에서도 p= 0.045의 결과를 보여주었다. 호르몬수용체 결과에서는 에스트로겐 수용체 양성의 환자가 전체 70% 정도를, 프로게스테론 수용체 양성의 환자가 약 65% 정도 차지하는 것을 알 수가 있었으며, HER-2에서도 전체 약 20%정도에서 3+의 양성임을 알 수 있었다(Table 2).
수술을 제외한 치료방법에 따른 결과로는 항암화학치료를 시행한 군이 317명(71.4%)를 차지하였으며, 각 혈액구성비에 따른 유의미한 결과는 보여주지 못하였다. 호르몬 치료를 받은 군 역시 호르몬 수용체 양성 환자의 비율과 유사하였고, 선택적 에스트로겐수용체 조절제 단독, 난소호르몬억제주사 및 타목시펜 병행사용, 아로마타제 억제재를 사용한 환자를 모두 포함하였다. 방사선 치료를 시행 받은 환자는 348명(78.38%)였으며, 역시 혈액구성비와의 연관성은 보이지 않았다. 다만, 재발, 전이성 유방암환자에서의 고식적 치료를 시행한 군과의 연관성에서는 각각 p= 0.027, 0.043으로 추가치료를 받은 39명의 환자에서 혈소판-림프구 비율 및 호중구-림프구 비율의 높고 낮음에 따른 유의미성을 보여주었다(Table 3).
다음으로 고려할 내용으로 수술 전 선행항암화학치료를 받은 52명의 환자에서 병리학적 관해여부에 따른 결과로 6명(11.54%)에서만이 관해의 소견을 보였으나, 혈액구성 비율에 따른 유의미한 결과값은 확인할 수 없었다. 다만, 전이와 재발 및 유방암과 관련한 사망의 측면에서는 p= 0.012, 0.003으로 혈소판-림프구 비율에서만 유의미한 결과를 보였으며, 호중구-림프구 비율 및 단핵구-림프구 비율에서는 연관성을 보이지는 않았다(Table 4).
또한, Cox-regression 모델을 이용하여 무병생존 및 전체생존과 관련된 수술 전 혈액구성 비율, 수술 후 병리결과와의 단변량 및 다변량 분석을 시행하였다. 먼저, 수술방법에 따라 유방보존술에 비해, 유방전절제술 및 즉시 복원을 한 환자군에서 위험비(hazard ratio, HR)가 각각 2.795, 3.532였고, 다변량 분석에서는 동일하게 전절제술의 경우 p= 0.011, 위험비 2.604로 무병생존과의 연관성을 확인하였으나 복원수술에서의 p 값은 유의미한 결과를 보여주지는 못하였다. 무병생존과 병기에 따른 결과 역시 병기 1에 비해, 2, 3, 4 각각 위험비 4.052, 11.291, 366.222 및 p< 0.003으로 단변량 분석에서는 유의성을 보였고, 전체 생존과 관련하여 병기 1에 비해 2, 3, 4 각각의 병기에서 위험비 5.177, 11.171, 103.374, p= 0.038, 0.003,< 0.001로 단변량 분석에서 연관성을 보였다. 이를 토대로 병기 1, 2, 병기 3, 4를 각각의 그룹으로 묶어 분석한 결과에서는 병기 1, 2에 비해 병기 3, 4의 위험비가 각각 5.975, 2.414이었고 p< 0.001, 0.027의 결과로 단변량, 다변량 분석에서 무병생존과의 유의미한 결과를 보여주었다. 또한, 에스트로겐 수용체의 경우에 위험비 0.271, 0.48, p< 0.001, 0.014로 에스트로겐 수용체가 양성일 때 무병생존의 위험도가 낮았고, 위험비 0.322, 0.407, p= 0.014, 0.019로 전체생존의 위험도가 낮음을 보여주었다. 프로게스테론 수용체의 경우에는 단변량 분석에서만 무병생존 및 전체생존과의 연관성을 보여주었다. 다만, HER-2의 경우에서는 무병생존 및 전체생존과의 유의성을 보여주지는 못하였다. 치료의 측면에서 선행항암화학치료를 시행한 군에서의 위험비가 유의하게 높았으며 (p< 0.001), 역시 보조요법으로 호르몬치료를 시행한 군에서의 위험비는 낮음을 알 수 있었다. 혈액구성 비율 중에서는 혈소판-림프구 비율에서만 cut-off value 158.84보다 높은 군에서의 위험비가 각각 2.472, 2.941, p = 0.004로 무병생존과의 연관성이 있음을 보여주었다(Table 5). 전체생존 역시 단변량, 다변량 분석에서 무병생존의 연관성과 유사한 결과값을 보여주었다. 그 외의 혈액구성비 측면에서는 유의한 결과를 보여주지 못하였다 (Table 6).
마지막으로 암 병기에 따른 전체생존율과 무병생존율의 Kaplan-Meier 생존분석을 시행하였고, 이전 표의 결과를 토대로 병기를 1과 2를, 그리고 3과 4를 각각 묶어 구분하였다. 무병생존 및 전체생존과 구분된 병기와의 측면에서는 p< 0.001로 유의미한 차이가 있음을 보여주고 있으며(Figure 2), 수술 전 혈액구성 비율에 따른 전체생존곡선에서는 혈소판-림프구 비율에서만 p < 0.001로 cut-off value에 따라 기준수치보다 낮을수록 생존의 좋은 결과를 보여주고 있음을 확인할 수 있었고, 호중구-림프구, 단핵구-림프구 비율에서는 생존과는 유의한 결과를 보여주지는 못하였다(Figure 3). 역시 전체생존곡선과 동일하게 무병생존과 수술 전 혈액구성 비율의 관련성에서도 혈소판-림프구 비율에서만 p = 0.003으로 무병생존과 연관성이 있음을 보여주었으며, 호중구-림프구, 단핵구-림프구 비율에서는 무병생존과의 유의한 결과를 확인할 수는 없었다(Figure 4).
고 찰유방암은 치료 도중 혹은 치료 후 수 년이 지난 시점에서도 재발과 전이의 위험성이 항상 존재한다. 현재까지 재발과 가장 관련 있는 요인들로 알려진 것들은 호르몬수용체, HER-2, Ki-67결과에 따른 유방암의 아형이 있으며, 진단 당시 나이, 수술 경계의 침범여부, 치료의 완료여부 등 다양한 범주에 연관된 요인들이 있다[12,13]. 이외에도 최근에는 Oncotype Dx, Mammaprint, PAM50과 같은 유전자분석기법을 통하여 환자의 재발가능성을 평가하고 적절한 치료를 적용하기도 하는데, 이는 차세대 염기서열분석 등 기술발전으로 인한 것이기도 하다[14,15]. 다만, 이러한 분석방법을 국내의 모든 환자에게 적용하기에는 비용 문제가 있어 현실적인 어려움이 있는 것이 사실이다. 그래서 본 연구는 수술 전 기본적으로 시행하는 혈액 검사를 통한 재발 및 전이와 연관된 인자를 찾아보고, 수술 후 병리 결과와는 어떠한 연관성이 있는지에 대한 의문에서 시작되었다. 병기를 1, 2와 3, 4로 구분한 것은 집단을 좀 더 단순화하여 조기 유방암과 진행성 유방암으로 구분되는 집단의 실제 결과차이를 보고자 하였고, 물론 병기 1, 2, 3, 4 각각의 결과값도 확인하였으나, 자료의 분포차이로 인한 유의미한 결과수준에는 도달하지 못하였다.
먼저, 수술 후 병리결과와 재발과의 연관성을 보았을 때, 호르몬수용체, 특히 에스트로겐 수용체의 결과는 양성의 경우 위험비율이 낮은 것으로 확인되었고 이는 기존의 연구결과[12]와 유사한 것으로 생각되었으나, HER-2 항목은 유의한 결과를 보여주지는 못하였다. 치료 방법의 측면에서는 선행항암화학치료를 시행한 군과 보조치료로서 내분비치료를 받은 군과 항암화학치료를 받은 군으로 구분하였으며, 방사선치료 시행여부에 따른 구분을 하였다. 선행항암치료를 받을 대상으로 판단되는 환자는 주로 T2 이상, 혹은 림프절 양성이나, 호르몬수용체 음성, HER-2 양성, 삼중음성 유방암이 될 것으로 생각이 되며[16], 이러한 조건은 본 연구에서도 재발과의 유의미한 연관성을 보이므로, 선행항암치료를 시행한 군에서도 동일한 결과를 보이는 것으로 판단된다. 다만, 선행항암치료를 받은 환자군이 52명이었고, 병리학적 완전 관해에 도달한 환자가 6명으로 집단의 표본이 적어 혈액구성비에 따른 차이 및 재발, 생존과의 측면에서의 연관성을 찾기는 어려웠다. 호르몬수용체가 양성인 군에서는 약제에 상관없이 내분비 치료를 시행하였으며, 관내강형의 내분비 치료를 받은 유방암환자에서는 재발의 위험도가 낮았음을 알 수 있다. 방사선 치료의 경우 재발 및 유방암으로 인한 사망의 측면에서 유의한 결과를 보이지는 못하였는데, 이는 수술적 방법에 따른 차이로 보인다. 조기유방암의 경우에도 유방 전 절제를 시행하는 경우가 드물지 않으며, 반대로 진행성 유방암에서도 유방보존을 시행하는 경우가 있으므로, 방사선 치료의 방법적인 차이는 있겠지만 병기의 경중으로 방사선 치료가 결정되지는 않으므로 환자의 생존과는 유의미한 결과는 없었다고 할 수 있겠다[17].
수술 전 혈액구성 비율에 따른 무병생존 및 전체생존의 측면에서는 호중구, 혈소판, 단핵구를 림프구로 나눈 비율이 중요한 연관성이 있을 것으로 생각하였다. 일반적으로 호중구는 자가면역 혹은 감염병과 연관성이 있는 것으로 알려져 있으나, 암세포의 진행 및 전이 등에도 주요한 역할을 하는 것으로 알려져 있다. 케모카인과 사이토카인은 종양주위 미세환경에서 상향 조절되어 약제에 대한 저항성을 나타내게 되며, 일부 단백질 등은 호중구를 암세포 주위로 끌어들여 항암의 효과를 저하시키기도 한다[18,19]. 이러한 인식으로 여러 암에 대한 혈액구성 비율에 따른 예후들이 보고되고 있으며[6], 유방암의 경우에도 호중구-림프구 비율이 높을수록 치료 후 예후에 있어 좋지 않은 것으로 보고가 되고 있다[9,20]. 다만, 본 연구에서는 기존의 메타분석[21]에서의 cut-off value의 범위인 1.9-5.0의 범주에는 들어가지 못하는 1.43으로 확인되었고 이것은 전체집단의 수 및 집단 변수의 차이에 따른 것으로 판단되며, 이로 인해 이미 보고되었던 결과와 차이가 있었던 것으로 판단이 된다. 혈소판과 암세포의 경우에도 호중구와 비슷한 개념으로 암세포가 혈액 내로 들어오면 혈소판이 활성화되면서 암세포를 자연살해세포(NK cell)의 공격으로부터 보호하게 되고, 혈소판에서 유래된 성장인자는 암세포의 증식을 일으키고 이동시키게 된다[22]. 본 연구에서의 혈소판-림프구비율의 cut-off value는 이미 보고된 연구[9,23]의 110-204의 범위를 158.84로 만족하고 있었으며, 전체생존 및 무병생존의 곡선에서 유의미한 연관성을 확인할 수 있었고, 재발 및 생존의 예후인자로 판단할 수 있을 것으로 생각된다. 단핵구 역시 암세포 환경에서 암의 진행, 억제의 기능을 하는 것으로 알려져 있고, 주로 신생혈관형성과 T 림프구기능의 억제와 종양세포독성을 일으키는 것으로 알려져 있다. 반대가 되는 암과 관련된 두 기능이 있으나 림프구의 기능과 관련하여 단핵성 골수체 유도 억제 세포(monocytic myeloid derived suppressor cell)는 T 림프구의 기능을 억제하여 암세포의 진행을 일으킨다[24]. 이미 보고된 연구에서 단핵구-림프구의 비율이 높을수록 재발 혹은 생존에 좋지 않은 결과를 보여주었고[8], 본 연구에서는 Figures 3, 4에서 시간의 개념이 포함된 생존, 재발 곡선에서는 유의미한 결과를 확인할 수는 없었으나, 다변량 분석에서 cut-off value 0.21 이상인 경우 위험비 0.384로 재발의 측면만을 보았을 때의 연관성은 확인할 수 있었다. 재발과 관련한 수술 후 병리결과는 기존에 보고된 연구들과 큰 차이점은 보이지 않았으며, 본 연구의 결과 역시 기존의 경향성을 잘 재현하였다고 판단한다. 다만, 수술 전 혈액구성 비율의 결과에서는 혈소판-림프구의 비율 결과에서만 기존에 보고된 연구와 비슷한 경향성을 보였으며, 그 외 항목에서는 유사한 결과를 도출하지 못하였는데, 집단의 구분으로 적절하지 않은 cut-off value가 획득되었거나, 두 군의 표본 수의 적절한 분배가 되지 않은 점이 결과 차이의 일부를 가져왔을 것으로 생각한다. 또한, 후향적 의무기록 분석에 의존하였기 때문에 일부 항목에 대해서 정확한 결과값을 참고하기 어려운 경우는 분석에서 제외되어 이런 요인도 결과값에 영향을 주었을 것으로 판단된다. 추후에는 군 간 적절한 표본 수의 자료수집이 필요할 것으로 보이며, 병기를 두 군으로 구분한 이번 연구와는 달리 병기 1에서 4까지 각각으로 분류하여 생존, 재발에 있어 세밀한 결과를 확인하는 것이 필요할 것으로 판단된다.
Figure 1.ROC curve analysis for the cut-off value. (A) Cut-off value of NLR, (B) Cut-off value of PLR, (C) Cut-off value of MLR. ROC=receiver operating characteristics; PLR=platelet-to-lymphocyte ratio; NLR=neutrophil-to-lymphocyte ratio; MLR=monocyte-to-lymphocyte ratio; Sp=specificity; Se=sensitivity; AUC=area under the curve. 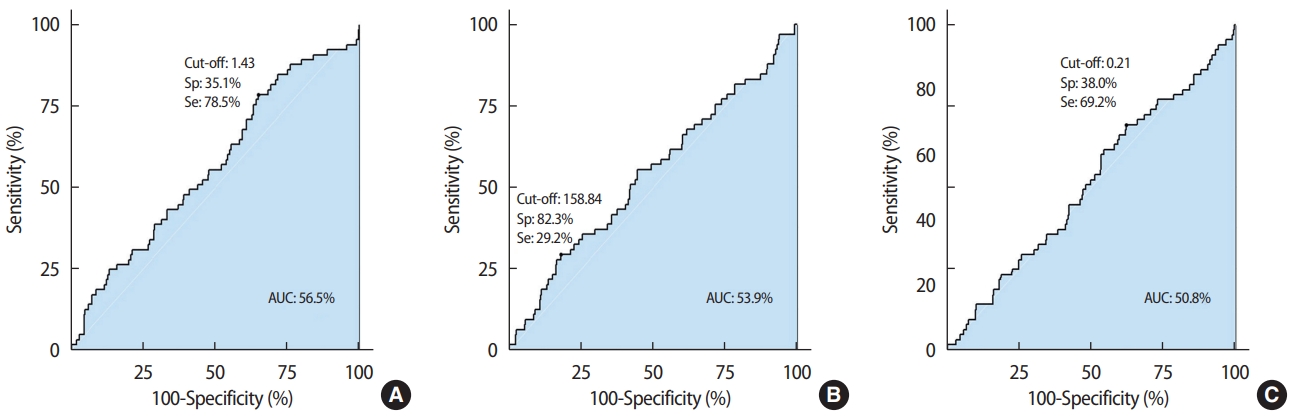
Figure 2.Kaplan-Meier survival curve according to stage 1 and 2 vs. 3 and 4. (A) Overall survival (B) Progression-free survival. 
Figure 3.Overall survival curve according to preoperative blood composition ratio. (A) Platelet-to-lymphocyte ratio, (B) Neutrophil-to-lymphocyte ratio, (C) Monocyte-to-lymphocyte ratio. 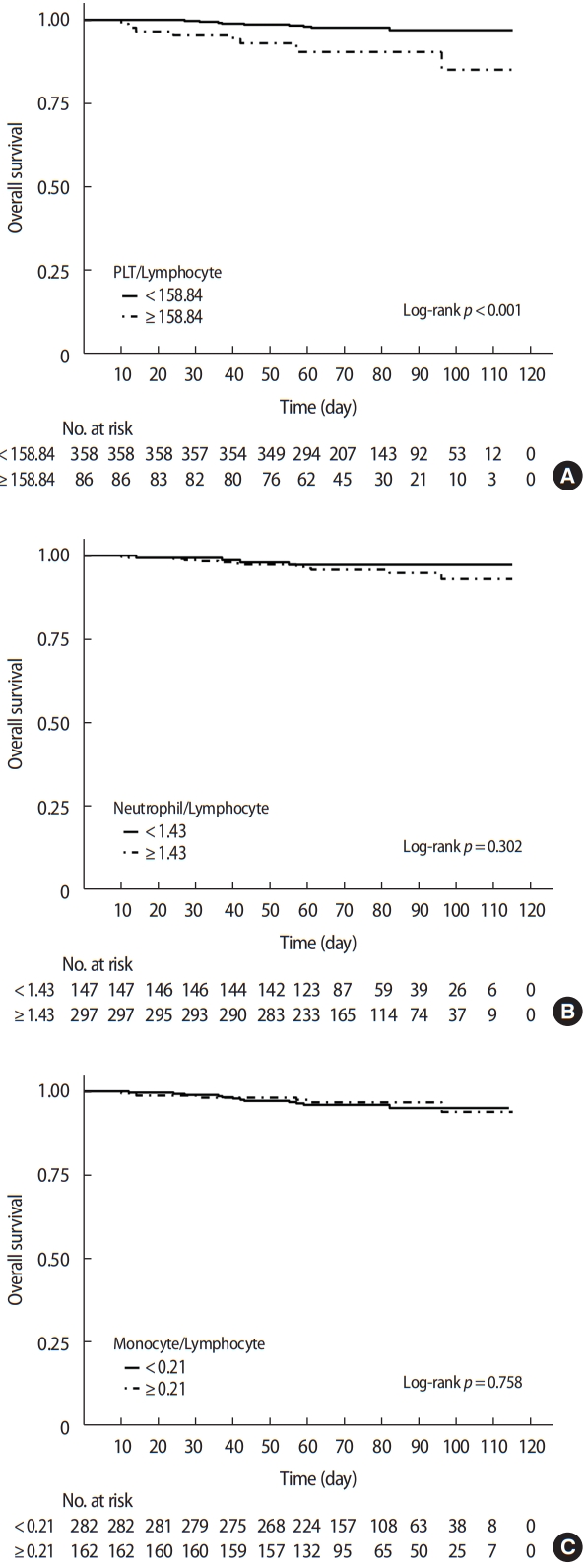
Figure 4.Progression-free survival curve according to preoperative blood composition ratio. (A) Platelet-to-lymphocyte ratio, (B) Neutrophil-to-lymphocyte ratio, (C) Monocyte-to-lymphocyte ratio. 
Table 1.Patients characteristics according to PLR, NLR, and MLR
Table 2.Pathologic findings according to PLR, NLR, and MLR
Table 3.Treatment modalities according to PLR, NLR, and MLR Table 4.Special concerns of patients according to PLR, NLR, and MLR
Table 5.Univariate and multivariate analysis for progression-free survival Table 6.Univariate and multivariate analysis for overall survival REFERENCES1. Breast Cancer Facts & Figures v.2020. Korean Breast Cancer Society. https://www.kbcs.or.kr/journal/file/210107.pdf. Accessed Aug 17th, 2021.
2. Yoon MR, Rhu JY, Song BJ, Chae BJ, Yoo TK. Treatment outcomes of weakly positive hormone receptor breast cancer and triple-negative breast cancer. J Breast Dis 2019;7:1-8.
4. Vicente Conesa, Garcia-Martinez E, Gonzalez Billalabeitia, Chaves Benito, Garcia Garcia, Vicente Garcia, et al. Predictive value of peripheral blood lymphocyte count in breast cancer patients treated with primary chemotherapy. Breast 2012;21:468-74.
6. Mazaki J, Katsumata K, Kasahara K, Tago T, Wada T, Kuwabara H, et al. Neutrophil-to-lymphocyte ratio is a prognostic factor for colon cancer: a propensity score analysis. BMC Cancer 2020;20:922.
7. Corbeau I, Jacot W, Guiu S. Neutrophil to lymphocyte ratio as prognostic and predictive factor in breast cancer patients: a systematic review. Cancers 2020;12:958.
8. Tiainen S, Rilla K, Hämäläinen K, Oikari S, Auvinen P. The prognostic and predictive role of the neutrophil-to-lymphocyte ratio and the monocyte-to-lymphocyte ratio in early breast cancer, especially in the HER2+ subtype. Breast Cancer Res Treat 2021;185:63-72.
9. Kim JY, Jung EJ, Kim JM, Lee HS, Kwag SJ, Park JH, et al. Dynamic changes of neutrophil-to-lymphocyte ratio and platelet-to-lymphocyte ratio predicts breast cancer prognosis. BMC Cancer 2020;20:1206.
10. Hawley ST, Janz NK, Griffith KA, Jagsi R, Friese CR, Kurian AW, et al. Recurrence risk perception and quality of life following treatment of breast cancer. Breast Cancer Res Treat 2017;161:557-65.
11. Wapnir IL, Khan A. Current strategies for the management of locoregional breast cancer recurrence. Oncology 2019;33:19-25.
12. Kim J, Lee Y, Yoo T, Kim J, Hyun J, Park I, et al. Organ-specific recurrence or metastatic pattern of breast cancer according to biological subtypes and clinical characteristics. J Breast Dis 2019;7:30-7.
13. Merino T, Ip T, Domínguez F, Acevedo F, Medina L, Villaroel A, et al. Risk factors for loco-regional recurrence in breast cancer patients: a retrospective study. Oncotarget 2018;9:30355-62.
14. Schunkert EM, Zhao W, Zänker K. Breast cancer recurrence risk assessment: is non-invasive monitoring an option? Biomed Hub 2018;3:1-17.
15. Yoshinami T, Kagara N, Motooka D, Nakamura S, Miyake T, Tanei T, et al. Detection of ctDNA with personalized molecular barcode NGS and its clinical significance in patients with early breast cancer. Transl Oncol 2020;13:100787.
16. Asaoka M, Gandhi S, Ishikawa T, Takabe K. Neoadjuvant chemotherapy for breast cancer: past, present, and future. Breast Cancer 2020;14:1178223420980377.
17. Shah C, Al-Hilli Z, Vicini F. Advances in breast cancer radiotherapy: implications for current and future practice. JCO Oncol Pract 2021;17:697-706.
18. Lecot P, Sarabi M, Pereira Abrantes, Mussard J, Koenderman L, Caux C, et al. Neutrophil heterogeneity in cancer: from biology to therapies. Front Immunol 2019;10:2155.
19. Wu L, Saxena S, Goel P, Prajapati DR, Wang C, Singh RK. Breast cancer cell-neutrophil interactions enhance neutrophil survival and pro-tumorigenic activities. Cancers 2020;12:2884.
20. Gago-Dominguez M, Matabuena M, Redondo CM, Patel SP, Carracedo A, Ponte SM, et al. Neutrophil to lymphocyte ratio and breast cancer risk: analysis by subtype and potential interactions. Sci Rep 2020;10:13203.
21. Ethier JL, Desautels D, Templeton A, Shah PS, Amir E. Prognostic role of neutrophil-to-lymphocyte ratio in breast cancer: a systematic review and meta-analysis. Breast Cancer Res 2017;19:2.
22. Schlesinger M. Role of platelets and platelet receptors in cancer metastasis. J Hematol Oncol 2018;11:125.
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||