서 론
암으로 인한 사망의 대부분 원인은 전이에 의한 것이다. 암이 발생한 장기로부터 신체의 다른 장기로 전이를 일으키기 위해서는 원발종양으로부터 이탈하여 순환 혈액으로 이동하게 된다. 대부분의 암세포는 원발 부위로부터 이탈 후 주변 세포나 조직으로부터의 더 이상 생존 신호를 받지 못하게 되어 스스로 사멸하게 되지만 일부 암세포는 원발 종양을 이탈한 이후에도 생존하여 궁극적으로 전이를 일으키게 된다. 순환종양세포(circulating tumor cells)는 악성 종양 환자의 말초혈액에서 발견되는 종양세포로 정의되며, 역사적으로 순환종양세포의 존재는 이미 백 년 전에 보고되었고, 원발 종양 및 전이가 발생한 조직 모두로부터 기원될 수 있는 것으로 알려져 있다[1].
암전이 과정에서 중요한 역할을 하는 순환종양세포에 대한 개념이 최초로 제시된 이후, 순환종양세포 연구는 오랜 기간 동안 매력적인 연구 주제였으나 말초혈액 내 순환종양세포 존재 수가 매우 드물어, 수백만 개 이상의 정상 혈구세포에 섞여 있는 수십 개 이하의 종양세포를 검출할 수 있는 정도의 민감도가 요구되는 검출 시스템이 필요하다. 이렇듯 분리에 필요한 기술적 문제가 지금까지 순환종양세포 연구의 가정 큰 제한점이었다. 최근 들어 공학 및 분자생물학의 비약적 발전에 힘입어 효율적인 순환종양세포 분리가 가능해 지면서 관련 연구가 다시 조명을 받고 있으며, 2000년대 중반을 지나면서 순환종양세포를 이용한 임상 연구가 학계에 지속적으로 보고되기 시작하였다. 지금까지 보고된 순환종양세포 연구 결과에 따르면 향후 암 진단, 치료 및 전이 과정 규명에 순환종양세포를 이용한 연구가 획기적인 변화를 가져올 수 있으며, 강력한 종양 마커(cancer biomarker)로써 순환종양세포의 이용 가능성이 대두되고 있다.
순환종양세포의 임상 적용
암 환자의 예후 평가
환자 개개인에 대해 예후를 평가하는 것은 대단히 중요한 임상적 의미를 갖는다. 지금까지 보고된 문헌에 의하면 진단이나 수술 당시 혈액 내 암세포의 존재는 환자의 불량한 예후와 관련이 있다고 일반적으로 인정되고 있다[2-6].
현재까지는 암의 크기나 림프절 전이 여부 등 원발 종양의 특성만을 고려하여 환자의 예후를 판정하고 있으나, 여기에 혈액 내 암세포를 이용한 정보를 추가하여 환자의 예후를 보다 세밀하게 구분할 수 있을 것으로 기대된다. 특히 조기 유방암 환자에서 불량한 예후가 예상되는 환자를 구별하여 적극적인 치료를 할 수 있으며, 반면에 양호한 경과가 예상되는 환자에서는 불필요한 항암 치료를 받지 않음으로써, 심독성과 같은 항암제의 치명적인 부작용을 사전에 피할 수 있을 것으로 기대된다.
치료 반응 평가 모델 개발
임상적 측면에서 순환종양세포 특성 분석을 통해 기대되는 또 다른 유용성은 항암제등의 치료 반응을 모니터링 할 수 있다는 점이다. 시행하고자 하는 항암제에 저항성을 보이는 환자군을 치료 초기에 선별할 수 있는 것은 매우 중요한 의미를 갖는다. 더구나 혈액 내 암마커 분석에 필요한 말초혈액의 채취는 상대적으로 비침습적(noninvasive)이고, 반복적 채취가 가능하다는 이점이 있다. 이 분야에서도 현재 기대되는 연구 결과들이 보고되기 시작하였다. 순환종양세포는 단순이 말초혈액에 종양 세포가 존재한다는 사실뿐만 아니라 동일한 환자에서 주기적으로 순환종양세포의 변화를 분석함으로써 현재 진행 중인 치료가 효과적인지, 혹은 현재 치료에 반응이 없거나 저항을 보이는지를 예측할 수 있다[7-9].
이는 현재 치료에 반응이 없는 환자를 선별해 냄으로써, 불필요한 치료를 중단하고 이에 따른 독성 및 부작용을 줄임과 동시에, 다른 치료를 받을 수 있는 기회를 제공함으로써 치료 효과를 극대화할 수 있다.
그러나 아직까지 미국임상종양학회(American Society of Clinical Oncology)에서는 순환종양세포를 이용하여 치료 방침을 결정하는 것을 인정하지 않고 있다. 이는 현재까지 순환종양세포 분석 방법이 통일되지 않았고, 기술적 문제점이 있으며, 전향적 임상 연구를 통한 검증이 이루어지지 않았기 때문이다[10].
순환종양세포 분자생물학적 특성 분석: 개인별 맞춤 표적 치료 실현
현대 항종양 약제(antitumor drug) 개발의 핵심 전략은 표적 치료제 개발로 함축할 수 있다. 즉, 종양세포의 성장, 증식, 전이를 조장하고 동시에 세포사멸을 억제하는 종양 세포신호 체제를 방해하여 항종양 효과를 극대화하는 것이다. 이러한 전략이 성공하기 위한 핵심 조건은 표적치료에 가장 적합한 환자를 치료 전에 선택하는 것이다. 이를 위해 현재까지 원발 종양에서 분자생물학적 특징을 분석하여, 관심 표적 발현 유무를 확인하고, 치료 대상 환자를 선정하고 있다[11].
대표적인 예가 유방암에서 human epidermal growth factor receptor 2 (HER2) 종양단백질을 표적으로 하는 약제의 개발이었으며, 이 중 하나인 trastuzumab (Herceptin)은 HER2 과발현 종양 환자에서 임상적 효과가 입증되었다[12-14].
그러나 많은 임상 상황에서 HER2와 같은 생물학적 표적을 검사하는 것이 용이하지 않다. 예를 들어 전체 전이성 유방암의 30% 이상을 차지하는 골전이(bone metastasis)의 경우 표적 발현 확인을 위한 조직의 확보가 대부분 어렵다. 더 나아가 다양한 치료 행위가 이루어지는 동안 조직의 표적 발현이 변할 수 있으며, 무엇보다도 치료 행위 중 반복적으로 검체를 확보해 정보를 얻는 것은 거의 불가능하다. 또한 어렵게 검체를 확보하였다 해도, 한 곳에서 채취한 종양세포가 여러 곳에 산재한 전이 병변의 특성을 대표할 수 있는지도 미지수이다[15].
이러한 어려움을 극복하기 위해 순환종양세포는 매우 매력적인 대안이다. 순환종양세포 는 비교적 용이하게 환자의 말초혈관에서 채취가 가능하며, 상대적으로 환자가 느끼는 고통이 적다. 무엇보다도 동일한 환자에서 반복적인 채취가 가능하다는 점이다. 또한 종양 조직의 분석에서 얻는 정보와 달리 환자의 혈액에 돌아다니는 종양세포의 특징에 대해 실시간 정보를 얻을 수 있다는 장점이 있다.
전이과정 규명
유방암 환자에서 대부분 질병관련사망(disease-related death)의 원인은 전신 전이(systemic metastasis) 발생에 의한 것이다. 항암제의 개선 및 표적 치료제의 개발 등에 힘입어 유방암 환자의 생존율이 꾸준히 증가하고 있으나, 진단 당시 림프절 전이 음성 환자의 약 20%-30%, 림프절 전이 양성 환자의 약 40%가 궁극적으로 전신 전이를 경험하여 사망하게 된다[16].
전신에 전이가 없는 조기 암환자에서 수술 및 방사선치료 등을 통해 종양조직을 완전히 제거한 후에도 치료 후 추적 과정에서 전신 전이가 발생하는 현상을 보면, 상당수의 환자에서 암의 초기 단계에 이미 암세포가 국소 영역을 이탈하여 전신에 미세한 전이(micrometastasis)를 일으키는 것으로 추정할 수 있다. 실제로 암세포는 원발 종양으로부터 암의 초기 단계에서도 혈액 내로 이동할 수 있으며, 이 중 일부는 상당 기간 혈액 내 머무를 능력이 있는 것으로 알려져 있다[17,18].
한편 순환종양세포는 매우 이질적인(heterogeneous) 세포들의 집합체로, 이들 중 일부가 궁극적으로 전이를 일으킬 능력을 가지고 있는 종양 세포로 추정된다. 최근 들어 유방암이 전이를 일으키기 위해 혈관 내로 종양세포가 이동하는 과정에서 종양의 분자생물학적 특징이 변화한다는 연구 결과가 발표되고 있다. 특히 원발 종양과 순환종양세포 간에 에스트로겐/프로게스테론 수용체 및 HER 발현이 다르며, 이러한 변화가 전이 과정에서 발생하는 중요한 기전일 가능성이 제기되고 있다. 이러한 사실은 유방암의 전이 과정을 이해하는 데 있어 중요한 개념의 변화로, 유방암 세포가 전이를 일으키기 위해 혈액 내로 이동하면서 종양이 좀 더 공격적인 패턴으로 세포의 아형이 변화하게 되고, 이때 HER2 음성 종양이 HER2 양성 발현으로 변화하며, 반대로 스테로이드 수용체 양성 발현 종양이 발현 음성으로 변화한다는 사실이다. 최근에는 순환종양세포 중 전이 능력이 있는 일부 세포에 대해 소위 ‘순환 암 줄기세포(circulating cancer stem cells)’ 개념이 대두되고 있으며[19,20], 아직 이에 대한 연구 결과가 거의 전무한 상황이지만, 본 연구를 통해 순환종양세포의 분자 생물학적 특성 분석이 가능해지면서, 향후 순환 암 줄기세포 연구로 연구 영역을 확장할 수 있을 것으로 기대하며, 궁극적으로 암 관련 사망의 대부분의 원인이 되고 있는 전이 현상에 대한 생물학적 기전을 밝힐 수 있을 것으로 기대된다.
국내외 연구 현황
순환종양세포 관련 국내외의 연구 현황은 현재까지 안정적으로 순환종양세포를 분리하기 위한 기술 개발에 집중되어 있으며, 대부분 분리 회수율과 분리 순도를 증가시키기 위한 연구들이 보고되고 있다. 또한 재현성을 올리고, 분리 과정을 자동화하는 연구가 진행되고 있다. 이와 관련하여 CellSearch, AdnaTest 등이 주목받고 있다.
그러나 현재까지 분리된 순환종양세포의 분자 생물학적 특성 분석을 위해 세계적으로 표준화된 방법은 없다. 앞서 기술한 바와 같이 암전이 과정을 연구하고, 치료의 최적화를 위해 분리된 순환종양세포에서 분자생물학적 특성을 분석하는 것이 매우 중요한 연구 주제로 부각하면서, Johnson & Johnson사에서 개발한 CellSearch System (Veridex, Raritan, USA), General Electric사에서 설립한 Biocept 등에서 활발히 연구가 진행 중인 것으로 알려지고 있으나, 아직까지 연구 결과가 발표되지 않았다. 이들은 모두 유방암 모델을 이용하여 순환종양세포를 분리하고, 분리된 순환종양세포의 특성 분석, 특히 HER2 발현 여부에 대한 분석을 중점으로 연구를 진행하고 있는 것으로 알려지고 있다. 이와 같이 순환종양세포 특성 분석, 특히 HER2 발현 분석을 위해 다양한 노력들이 진행되고 있으나, 현재까지 표준화된 연구 결과는 없는 실정이다.
순환종양세포의 특성 분석을 위해 지금까지 표준화된 연구 결과가 없을 뿐만 아니라, 각각의 방법들이 서로 다른 부유화 과정(enrichment procedure: density centrifuge, filteration, and immuno-magnetic beads) 및 서로 다른 검출 전략(reverse transcription polymerase chain reaction [RT-PCR], immunocytochemistry, and immunofluoresence)을 시도하고 있으며, 심지어 사용하는 종양 세포 표지자(cytokeratins, mucins, mammaglobin, etc.)조차도 서로 다른 것이 현실이다. 따라서 민감도, 특이도 및 재현성이 우수한 표준화된 검출 시스템을 개발하는 것은 임상 현장에서 매우 유용한 선도 기술로 현재까지 미충족 의료수료로 충분한 경제적 개발 가치가 있을 것으로 판단되며, 국제적 경쟁력을 선점하여 경제적, 기술적 유망기술로 기대된다.
qRT-PCR을 이용한 순환종양세포 검출
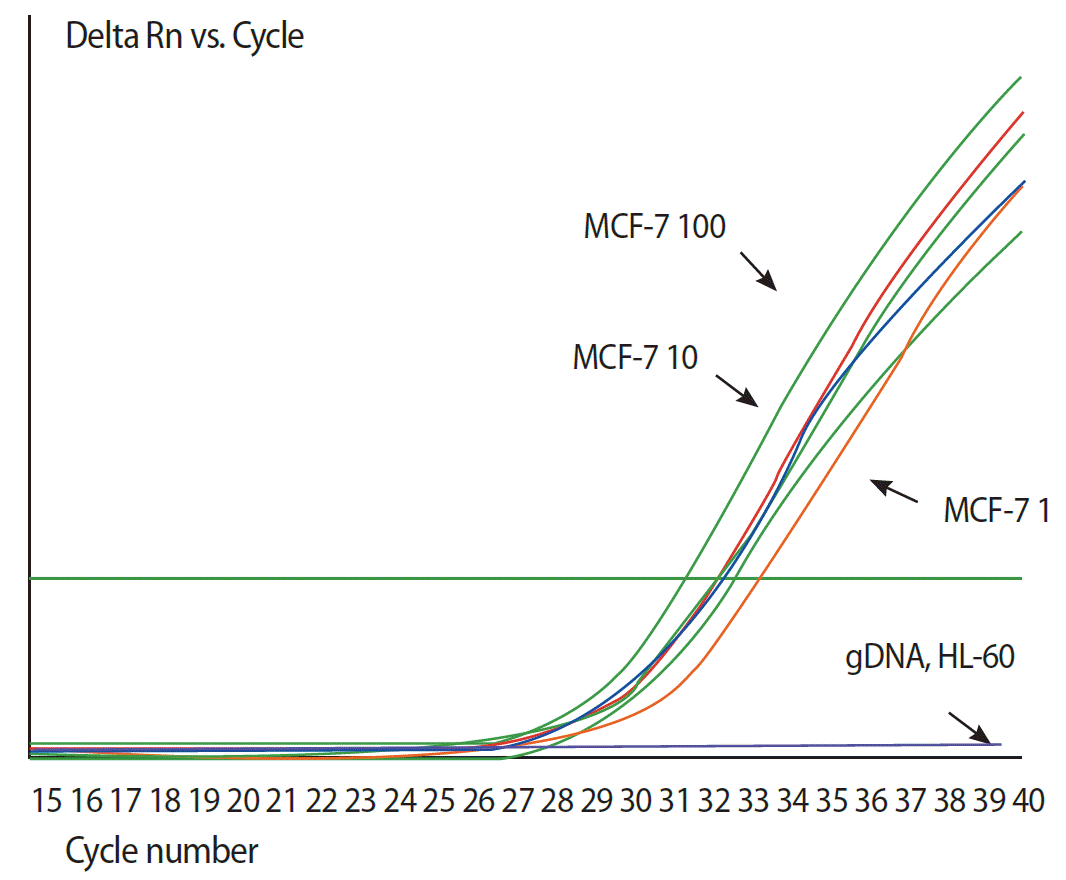
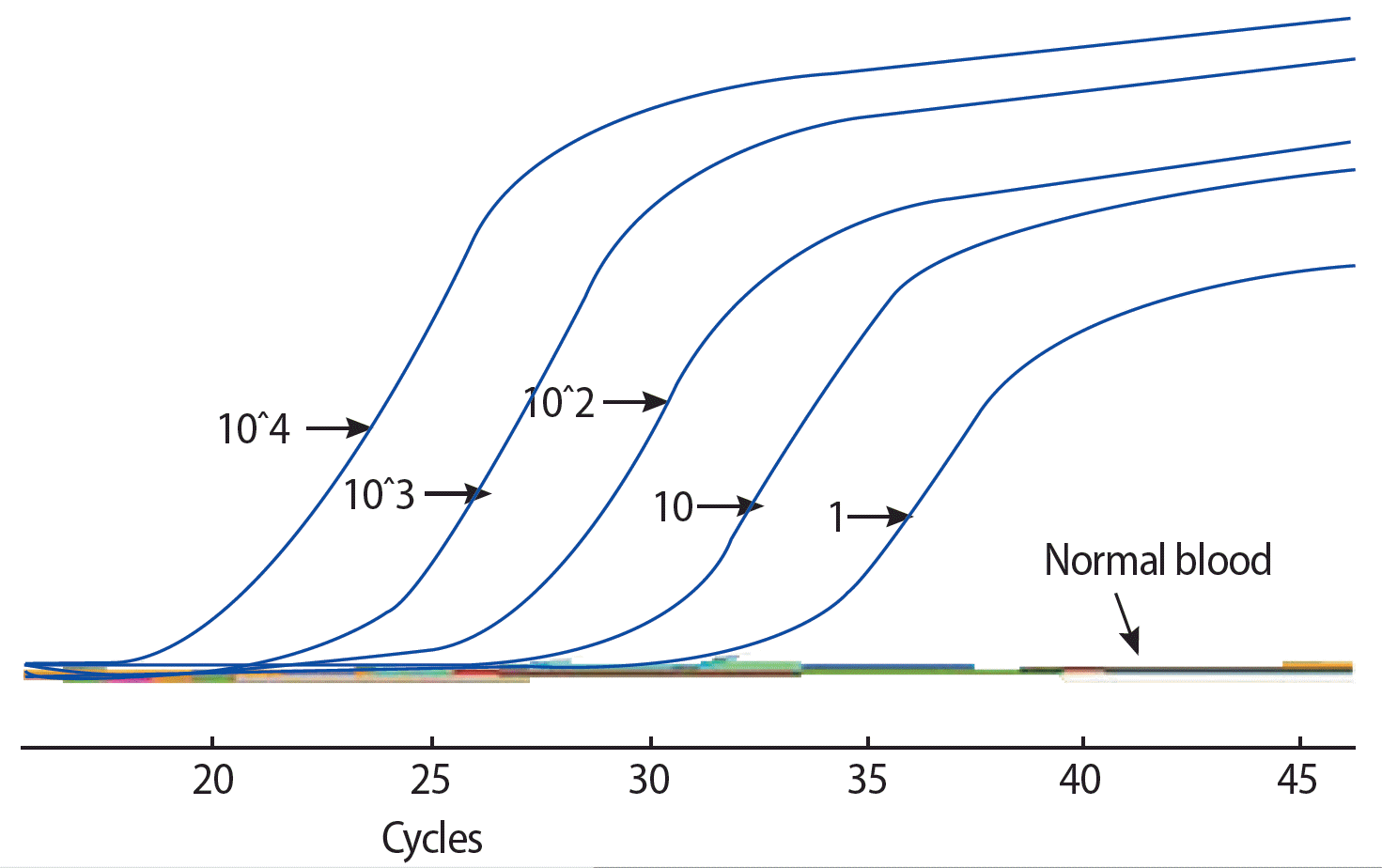
저자 등은 연구 시작의 첫 단계로 먼저 순환종양세포 존재 유무에 대한 안정적인 측정 방법이 필요하다고 판단하였다. 즉, 순환종양세포를 이용한 분자생물학적 특성 규명 연구에 앞서 순환종양세포의 존재 유무를 매우 민감하게 검출해내는 기술 개발이 선결되어야 한다고 판단된다. 현재까지 순환종양세포 검출에 가장 민감한 방법은 말초혈액에서 총 RNA를 분리하고, 여기에서 상피세포에서만 발현하는 RNA를 검출하는 방법이다. 이를 위해 자체 제작한 cytokeratine-19에 대한 primer (NCBI reference sequence: NM_002276.4, sense primer 5’-gatgagcaggtccgaggtta-3’, antisense primer 5’-atgaaagctgcct tggaagacac-3’)을 이용하여 qRT-PCR을 시행하였으며, 실험은 정상인 말초혈액 7.5 cc에 유방암 세포주인 MCF-7 (ATCC, Rockville, USA)을 각각 1개, 10개 및 100개씩 spiking한 후, cytokeratine-19을 검출하는 것으로, Figure 1에서 보듯이 약 7.5 cc 혈액에 spiking된 한 개의 암세포를 검출할 수 있다. 이는 수 백만 개의 정상 혈구세포에 섞여 있는 한 개의 암세포를 검출할 수 있는 정도의 민감도이다. 그러나 qRT-PCR 방법은 높은 민감도에 비해 낮은 특이도가 문제로 저자 등은 이 문제의 해결을 위해 혈액 전처리 과정에서 새로운 실험 단계를 추가하였으며, 7.5 cc 말초혈액에 있는 한 개의 암세포를 검출하는 민감도를 유지하면서, 33명의 정상인 혈액에서는 전혀 qRT-PCR 반응이 일어나지 않는 높은 특이도의 qRT-PCR 프로토콜을 최종 개발하여 순환종양세포의 존재 여부를 안정적으로 평가할 수 있는 시스템을 개발하였다(Figure 2).
미세유체역학을 이용한 순환종양세포 분리 마이크로칩 개발
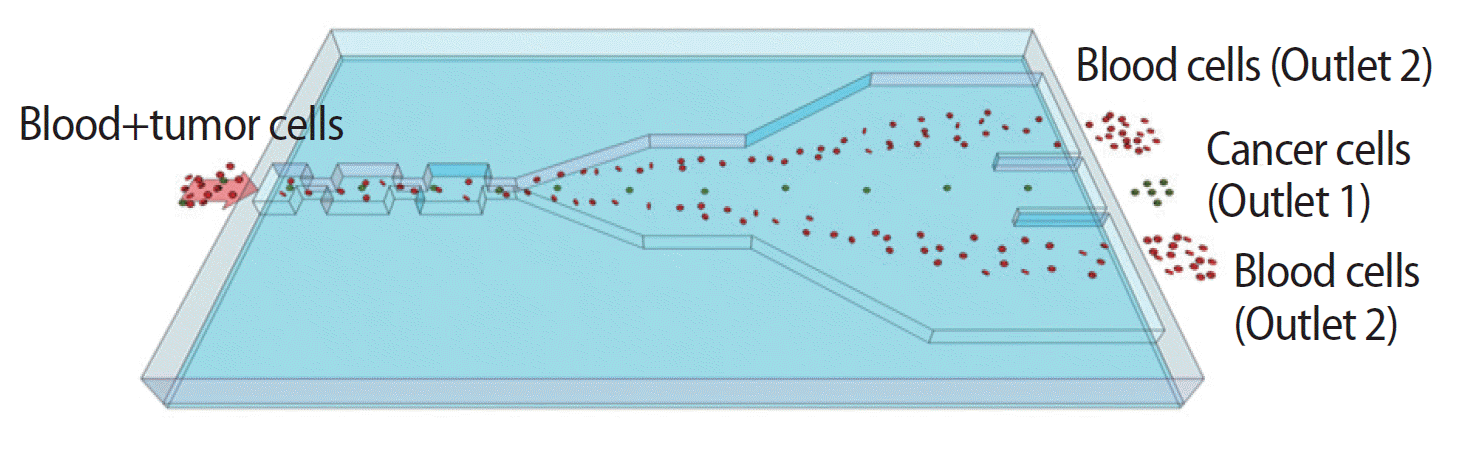
qRT-PCR를 이용한 순환종양세포 검출은 실험이 용이하고, 검출 민감도가 높다는 장점이 있지만, 분리 이후 이차적인 분자생물학적 분석이 불가능하다는 단점이 있다. 이에 저자 등은 미세유체역학을 이용하여 종양세포 자체를 분리할 수 있는 마이크로칩을 개발하여 왔으며, 병렬구조의 다중 오리피스 유동분획 칩(label-free microfluidic flow fractionation device, MOFF)의 기본 원리를 Figure 3에 도시하였다. 작동원리는 입자들이 마이크로칩상에서 1차적으로 tubular pinch effect에 의해 원형 띠 형태로 모이게 되고, 동시에 secondary flow에 의하여 수평면상으로 2차적인 힘을 받게 된다. 저자 등은 반복적인 시뮬레이션 및 실제 혈액을 이용한 연구를 통해 입자가 출구 쪽에 갈수록 양쪽 벽면으로 focusing이 되는 현상을 확인하였다. 이를 이용하여 세포를 크기별로 분리하여 12-25 μm의 암세포는 관내의 중심으로, 8-14 μm의 혈액세포는 관의 가장자리로 모이도록 조절하였다. 최대 10 mL의 혈액을 시스템 내에서 처리하는 데 필요한 시간은 15분 이내로, 회수율 및 순도에 있어 세계적인 경쟁력을 확보하였으며, 관련 연구 결과를 학계에 보고하였다[21-23].
저자 등은 MOFF 마이크로칩의 자동화를 구현하기 위해 전향적 연구를 계속 진행 중에 있으며, Figure 4는 연구진이 확보하고 있는 순환종양세포의 분리, 염색, 스캔 및 검출을 위한 전체 MOFF 시스템 구성도이다.
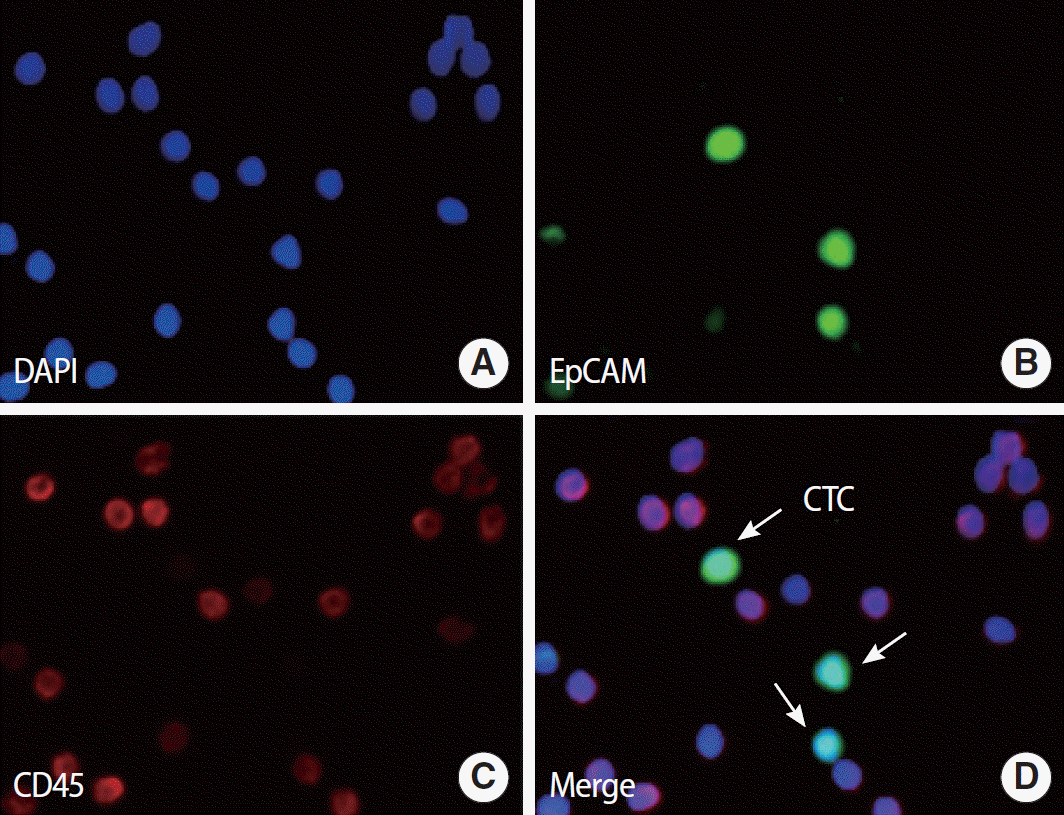
MOFF 마이크로칩을 이용하여 분리된 세포들은 상피세포 표지자를 이용하여 최종적으로 순환종양세포 검출 단계를 거치게 된다. 이때 3가지 표지자를 이용하는데, 실제 세포임을 확인하지 위해 DAPI, 상피세포 표지자인 EpCAM, 백혈구 표지자인 CD 45를 이용하게 된다. 최종적으로 DAPI 양성, EpCAM 양성이면서, CD 45 음성인 세포를 CTC로 정의한다. 저자 등은 실제 암환자에서 원발 종양 부위를 이탈하여 전이 능력을 확보하고 혈액 내 생존하고 있는 종양세포를 분리하여 국내 최초로 보고하였다. Figure 5는 실제 유방암 환자에서 3가지 마커를 염색한 후 최종 분리, 검출한 순환종양세포이다.
비표지자 방식의 세포 분리
최근에 혈액 내 순환종양세포의 임상적 유용성에 대해 희망적인 결과들이 보고되고 있지만, 현재 세포 분리 기술은 암세포가 상피세포에서 기원하였다는 가정 하에 상피세포 유래 세포막 단백질 마커(EpCAM)를 양성적 선택 마커로 사용함으로써, 1) 혈액에서 세포막 상에 상피세포가 탈락되었거나, 2) 서로 상이한 기원의 순환종양세포이거나, 3) 상피세포에서 간엽세포로 전이(Epithelial-Mesenchymal Transition)하는 실제로 전이능이 높은 세포, 특히 4) 순환줄기종양세포를 검출하지 못한다는 치명적인 약점이 있다. 저자 등은 이러한 문제를 해결하기 위해 순환종양세포 세포 분리 시스템을 비표지 방식으로 선택하였으며, 현재 EpCAM 발현 여부와 관계없이 암세포를 분리, 검출하는 기술을 확보하고 있다.
결 론
현재까지 순환종양세포 관련 연구는 주로 말초혈액 내 순환종양세포 존재 유무를 측정하여 암환자의 개별적인 예후를 예측하거나, 치료 중 순환종양세포의 양적인 변화를 일정한 간격으로 관찰해서 현재 진행하고 있는 치료에 대한 반응을 평가하는 수준이다. 그러나 현재의 연구 추세로 볼 때, 향후 순환종양세포 연구는 단순한 세포 분리 수준을 넘어, 암세포가 원발 종양에서 이탈하여 혈액 내로 이동하는 과정에서 일어나는 분자생물학적 차원의 변화를 규명하는 단계로 발전할 것으로 예측된다. 즉, 단순한 순환종양세포 분리 수준을 넘어 분리된 종양세포를 이용하여, 악성 종양의 발암, 증식, 전이 및 치료 선택 과정에 중요한 생물학적 마커를 규명함으로써 악성 종양의 전이 현상에 대한 추가적인 정보를 제공할 수 있을 것으로 기대되며, 더 나아가 유방암 환자의 예후 평가, 치료 과정 모니터링 수준을 넘어 개별 환자 맞춤 치료제 선택에 유용한 정보를 제공할 수 있을 것으로 기대된다.